
1. 德国应用化学会的《Angew Chem Int Ed Engl.》刊物发表了国家蛋白质科学研究(上海)设施用户在谷氨酰胺结合蛋白质GlnBP的构象动力学方面的研究进展。
2016年10月12日,复旦大学王文宁教授及其合作者在德国应用化学会《Angew Chem Int Ed Engl.》刊物发表题为“Conformational Dynamics of apo-GlnBP Revealed by Experimental and Computational Analysis.”的论文。
谷氨酰胺结合蛋白质GlnBP可以结合L型谷氨酰胺,并且与转运体协同配合完成谷氨酰胺的细胞摄入。晶体学研究表明GlnBP蛋白质存在“打开”和“关闭”两种结构。但是,构象变化动力学行为一直不清楚。该研究综合利用液体核磁、分子动力学模拟和单分子FRET等技术研究apo-GlnBP蛋白质的构象系综。核磁共振残余偶极耦合(RDCs)实验数据与分子动力学模拟的四个构象组成的系综模型相吻合,其中晶体结构之前发现的“打开”和“关闭”状态只是该系综的两种主要构象(如图一所示)。其它两种构象状态的存在,证明了该蛋白质与配体相互作用的构象选择机制。
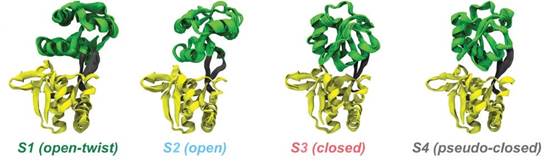
图一:apo-GlnBP蛋白质的四态构象系综示意图,S2和S3对应晶体结构的两种主要构象。
香港科技大学的黄旭辉教授和复旦大学的刘建伟教授是该文章的共同通讯作者,该研究得到了国家重点研发计划项目和国家基金委的经费支撑。蛋白质设施核磁系统技术主管刘志军博士,作为该文章的合作者,帮助用户在上海设施A800谱仪上完成了核磁RDCs实验,并协助分析数据。
论文链接:http://onlinelibrary.wiley.com/doi/10.1002/anie.201606613/abstract
2. 英国皇家化学会的《Physical Chemistry Chemical Physics》刊物以封底形式报道了国家蛋白质科学研究(上海)设施用户在核磁技术表征蛋白质低丰度激发态方面的核磁新方法研究进展。
2016年3月10日,中国科技大学阮科教授及其合作者在英国皇家化学会的《Physical Chemistry Chemical Physics》刊物发表题为“Determination of Pseudocontact Shifts of Low-Populated Excited States by NMR Chemical Exchange Saturation Transfer”的论文, 该文章作为Featured article在期刊back cover特别推荐。
激发态在蛋白折叠、分子识别、酶催化等方面发挥着重要作用,但由于丰度很低,大多数的结构生物学手段难以表征激发态构象。核磁共振化学交换饱和转移实验可以获取与蛋白基态慢交换的激发态化学位移。然而仅通过化学位移计算结构面临着巨大的挑战,因此迫切需要开发新的技术以获取激发态的更多结构信息。我们提出了赝接触位移-化学交换饱和传递(PCS-CEST)方法(如图二所示),测定的激发态赝接触位移富含蛋白质中各原子的距离和取向的结构信息。我们首先在Abp1p SH3-Ark1p慢交换体系中验证了这一方法,激发态的赝接触位移与结合小肽时的数据吻合很好。我们继而发现FF结构域激发态的赝接触位移远远小于基态的数值,这说明自由的FF结构域预先存在着蛋白折叠中间体,其构象是基本无序的。最后提出了选择性的一维CEST实验,可以用更少的时间、更高的数据分辨率,来获取激发态的化学位移和赝接触位移。
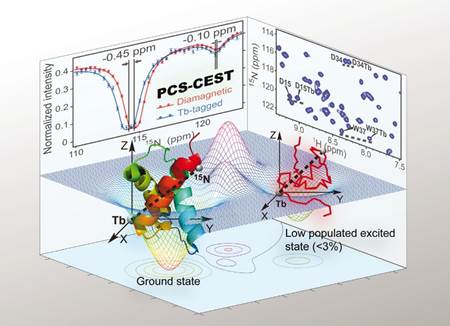
图二:PCS-CEST核磁新方法示意图
南开大学的苏循成副教授是该文章的共同通讯作者,该研究得到了科技部973项目和国家基金委的经费支撑。蛋白质设施核磁系统技术主管刘志军博士,作为该文章的合作者,帮助用户在上海设施A800谱仪上完成了核磁CEST实验。
论文链接:http://pubs.rsc.org/en/content/articlehtml/2016/CP/C6CP01127F
3. 美国化学会的《Journal of the American Chemical Society》刊物发表了国家蛋白质科学研究(上海)设施用户测量蛋白质内部氢键网络协同性方面的核磁方法学研究进展。
2016年2月17日,青岛能源所姚礼山研究员及其合作者在《Journal of the American Chemical Society》刊物发表题为“Observation of α-Helical Hydrogen-Bond Cooperativity in an Intact Protein”的论文。
蛋白质内部的氢键网络协同性对于维持蛋白质折叠和功能状态非常重要,如何在实验中观察到这种协同性并定量研究,是非常重要的科学问题。该研究充分利用液体核磁共振技术的氢氘交换实验和量子化学模型计算,首先在实验上观察到在a-螺旋第i位点上的NH被ND取代,通过削弱N-H…O=C氢键,可以影响到i-3或i+3位点上氢键受体的化学位移变化(如图三所示)。其次,通过量化模型计算证明这种变化与氢键网络的协同性相关,并可以用来估算螺旋氢键的协同性强度。该研究提供了一种定量研究蛋白质内部氢键协同性的新方法。
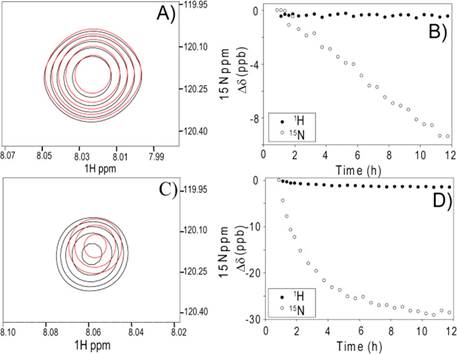
图三:核磁共振技术的氢氘交换实验测量氢键网络协同性的示意图
该研究得到了国家基金委的经费支撑。蛋白质设施核磁系统技术主管刘志军博士,作为该文章的合作者,帮助用户在上海设施B600谱仪上完成了核磁三共振实验。
论文链接:http://pubs.acs.org/doi/abs/10.1021/jacs.5b13140
(蛋白质上海设施供稿)