
2017年10月12日,国家蛋白质科学研究(上海)设施质谱分析系统用户浙江大学医学院刘伟教授课题在Molecular Cell杂志在线发表题为“mTORC1 Phosphorylates Acetyltransferase p300 to Regulate Autophagy and Lipogenesis”的研究论文,该研究发现调控细胞生长和代谢的重要蛋白复合物mTORC1通过磷酸化p300,解除p300的分子内抑制作用(Intra-molecular inhibition),促进p300的激活。功能研究发现,mTORC1-p300通路在自噬起始和脂质生成的过程中发挥重要调控作用,提示该通路在协调细胞内分解代谢和合成代谢过程中扮演关键角色。值得一提的是,这是该课题组在上海设施质谱系统支持与帮助下,发表的第三篇Molecular Cell (2015年11月,该课题组组发现了一条激活组蛋白脱乙酰化酶Sirt1启动细胞自噬的新的信号途径;2017年8月,该课题组发现了p300介导的乙酰化修饰在VPS34激活中的关键作用,阐述了这一新机制在启动经典自噬和非经典自噬中的重要意义)。
蛋白的乙酰化参与调控细胞代谢的众多环节,提示乙酰转移酶/去乙酰化酶在细胞代谢调节中发挥重要作用。最近的研究发现,p300在细胞内重要的分解代谢过程自噬中发挥调控作用。p300通过乙酰化自噬相关蛋白LC3,Atg5和Atg7抑制自噬的起始。葡萄糖饥饿时,这些蛋白的去乙酰化酶Sirt1被AMPK激活,诱导自噬相关蛋白去乙酰化,促进自噬的发生。然而,在抑制Sirt1活性时,剥夺氨基酸或者用mTORC1的抑制剂雷帕霉素(rapamycin)处理细胞,并不能阻止LC3的去乙酰化,自噬也会正常发生。与此类似,在Sir2(Sirt1在线虫中的同源蛋白)敲除的线虫中,雷帕霉素也可以诱导自噬的起始。以上发现促使研究人员探究mTORC1调控乙酰转移酶p300的可能性。
该研究中,研究人员通过基因高表达、基因敲低/敲除、体外激酶反应、质谱分析和位点突变等手段发现mTORC1能够直接磷酸化乙酰转移酶p300,并鉴定出位于p300羧基端结构域的S2271,S2279,S2291和S2315是主要的磷酸化位点。接下来,他们通过改变mTORC1的活性、构建p300模拟磷酸化和去磷酸化突变体,结合一系列细胞内外实验发现,mTORC1介导的磷酸化能够显著激活p300的乙酰转移酶活性。
利用纯化蛋白进行体外蛋白相互作用实验,他们发现mTORC1介导的磷酸化通过抑制p300的RING结构域和HAT结构域的结合,解除RING结构域的分子内抑制作用,促进p300的激活。继而,研究人员检验了该mTORC1-p300通路在自噬启动和脂质生成中的作用。营养缺乏时,p300去磷酸化,活性受到抑制,LC3等自噬蛋白发生去乙酰化并被激活,自噬随之启动;营养充足时,mTORC1磷酸化p300并激活其活性,激活的p300乙酰化调控脂质生成的关键转录因子SREBP-1c,提高其转录活性,促进脂质生成(图1)。
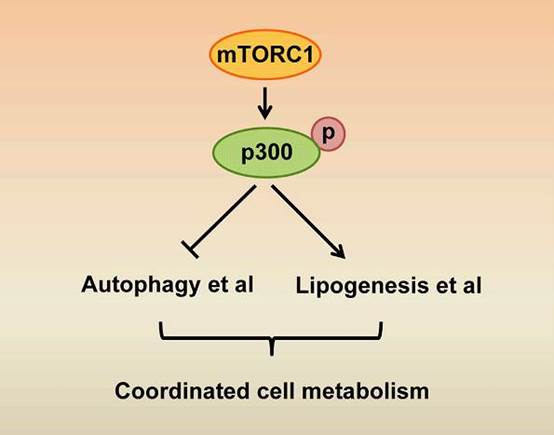
图1: mTORC1-p300通路参与调控自噬启动和脂质生成
综上所述,该研究建立了细胞内调控细胞代谢和基因表达两大重要蛋白(蛋白复合物)mTORC1和p300之间的直接调控关系,确定了p300在介导mTORC1信号中的重要地位。
刘伟教授研究组的博士生万伟是本文的第一作者,刘伟教授为本文通讯作者。质谱系统彭超博士参与了相关研究工作,利用质谱技术完成了相关蛋白质后修饰位点的鉴定,为课题提供了关键的支持和保障,为文章的共同作者。该项目得到了国家自然科学基金重点项目和国家重点基础研究发展计划的资助。
论文连接:http://www.cell.com/molecular-cell/fulltext/S1097-2765(17)30698-6
(上海设施提供)