
12月13日,国际著名学术期刊 《Cell》 在线发表了中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)刘默芳研究组联合多家单位实验室合作完成的研究成果“A translation-activating function of MIWI/piRNA during mouse spermiogenesis”。该研究揭示了MIWI/piRNA激活小鼠精子细胞中mRNA的翻译,从而保障功能性精子的生成。
减数分裂后的精子形成是动物体内一种高度复杂的生化和细胞形态变化过程。基因表达的时空特异性调控对于该过程的顺利进行具有至关重要的作用。在精子细胞发育后期,染色质中的组蛋白被鱼精蛋白取代使染色质高度压缩,导致基因转录终止,那些为后期精子细胞发育所需的基因就需要在早期精子细胞阶段提前转录成mRNA,并以核糖核蛋白体(mRNP)的形式储备起来,在之后的特定发育阶段激活翻译。因此,相对于体细胞,精子细胞中mRNA转录与翻译的解偶联是一个非常普遍的事件。而对于这些被抑制的mRNA是如何被激活翻译的还知之甚少。
piRNA是在动物生殖系细胞中发现的一类小分子非编码RNA,因其特异性地与生殖细胞专一性PIWI家族蛋白相互作用而被命名为PIWI-interacting RNA,简称为piRNA。目前认为,piRNA与PIWI蛋白形成的复合体可以沉默基因组中的可移动性遗传元件,从而维持生殖细胞基因组的稳定性和完整性。此外PIWI/piRNA还可以在转录后水平负调控mRNA,参与了生殖细胞中编码基因的表达调控【1, 2】PIWI/piRNA是否参与了早期被抑制mRNA的翻译激活呢?
该项研究首先通过国家蛋白质(上海)设施复合激光显微镜系统的BD influx流式细胞分选仪分离并富集单倍体精子细胞并用MIWI特异性抗体进行RNA免疫共沉淀,富集与MIWI蛋白结合的RNA。通过大规模筛选发现MIWI/piRNA可以“正向”调控靶基因的表达,暗示MIWI/piRNA可能在精子细胞中的“转录-翻译解偶联”中发挥作用。以此为出发点,研究人员鉴定到真核生物翻译起始因子eIF3f “协助” MIWI/piRNA完成了对靶基因在翻译水平上的调控。在刘默芳研究组的前期研究中,她们发现小鼠PIWI(MIWI)/piRNA通过类似miRNA或siRNA的机制,在小鼠后期精子细胞中介导mRNA降解和清除【3,4】。MIWI/piRNA是通过怎样的机制来实现这两种不同的调控的?通过进一步的生物信息学分析发现受到MIWI/piRNA翻译激活的靶基因的3′UTR序列处均含有HuR所特异性结合的RNA序列特征。HuR不仅稳定和保护了这些被暂时“扣押”的mRNA,还通过与MIWI/piRNA,eIF3f,eIF4G,PABPC1等因子在单倍体精子细胞中的结合促进了mRNA翻译起始阶段“closed loop”结构的形成,从而激活了靶基因的翻译(图1)。
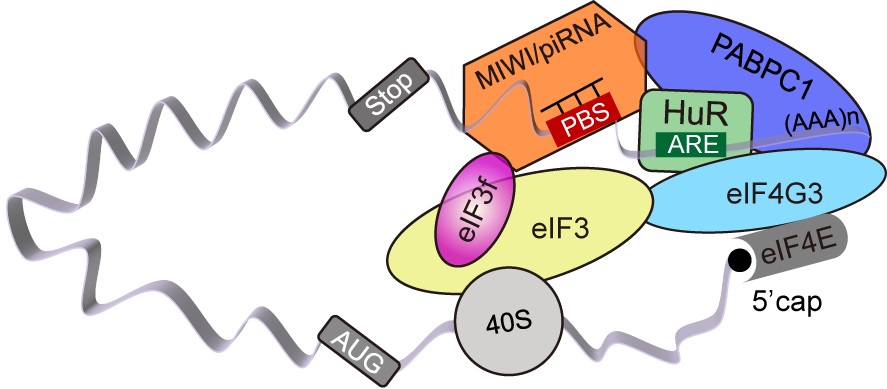
图1:MIWI/piRNA介导的翻译激活模型
随后,研究人员又通过流式细胞分选仪分离并富集小鼠精母细胞和单倍体精子细胞(图2),并分析靶基因mRNA和蛋白的表达水平,发现这些靶基因受控于“转录-翻译解偶联”调控,并证明MIWI、HuR等为这些靶基因的蛋白翻译必需(图3)。进一步,通过核糖体印迹测序技和定量蛋白组分析,研究人员发现精子细胞中有一大群mRNA的翻译可能都受控于MIWI/piRNA,显示这种新发现的MIWI/piRNA调控作用广泛参与精子细胞中的mRNA翻译激活。
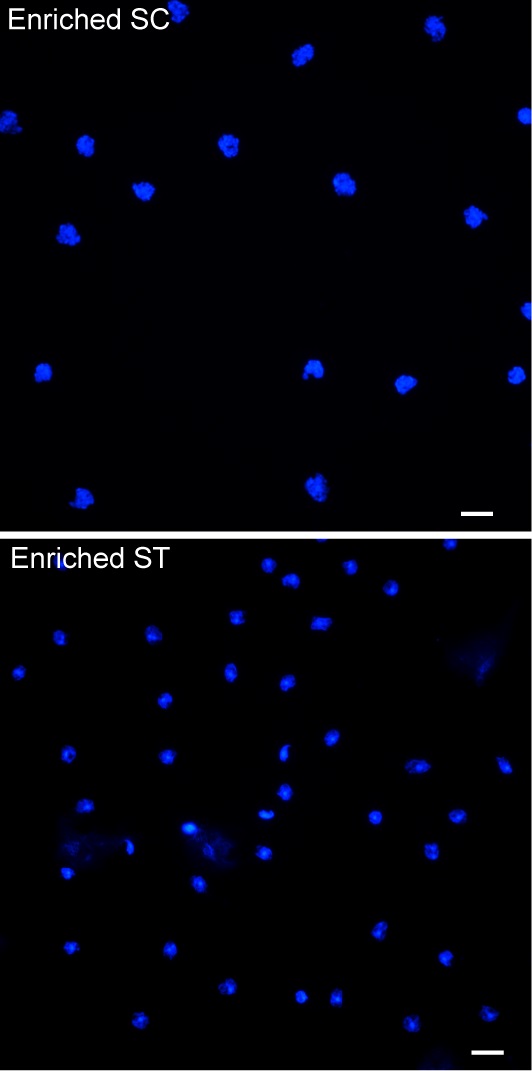
图2:流式细胞仪分离富集小鼠精母细胞和单倍体精子细胞
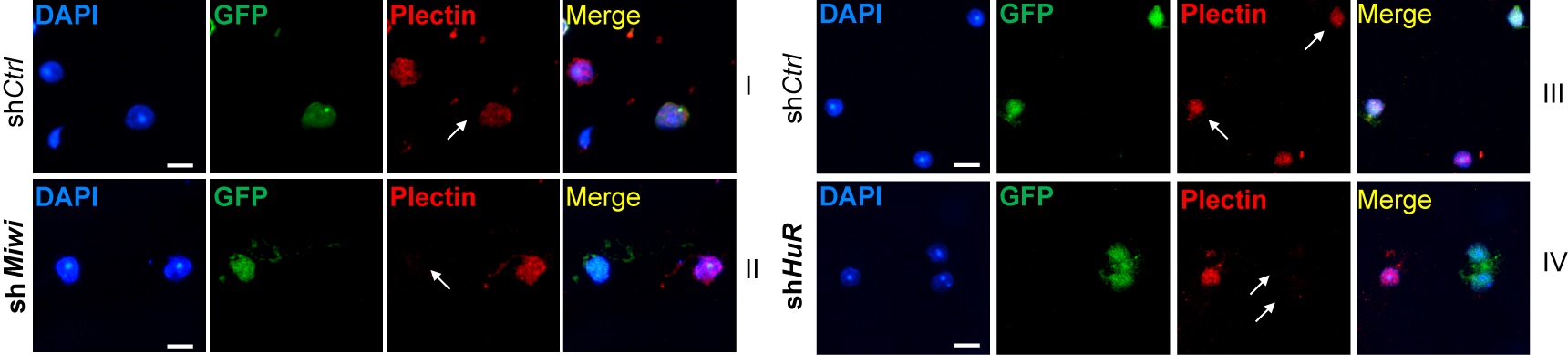
图3:敲低Miwi和HuR抑制了内源靶基因的翻译
为探索该MIWI/piRNA新调控作用的生物学功能,围绕对顶体组装至关重要的两个靶基因Agfg1和Tbpl1【5,6】,研究人员发现从Miwi敲低精子细胞衍生而来的精子发生了严重的顶体缺陷,而通过在Miwi敲低精子细胞中恢复Agfg1和Tbpl1的表达,有效拯救了精子的顶体缺陷(图4),证明MIWI/piRNA介导的翻译激活作用至少为精子细胞发育过程中的顶体组装必需。
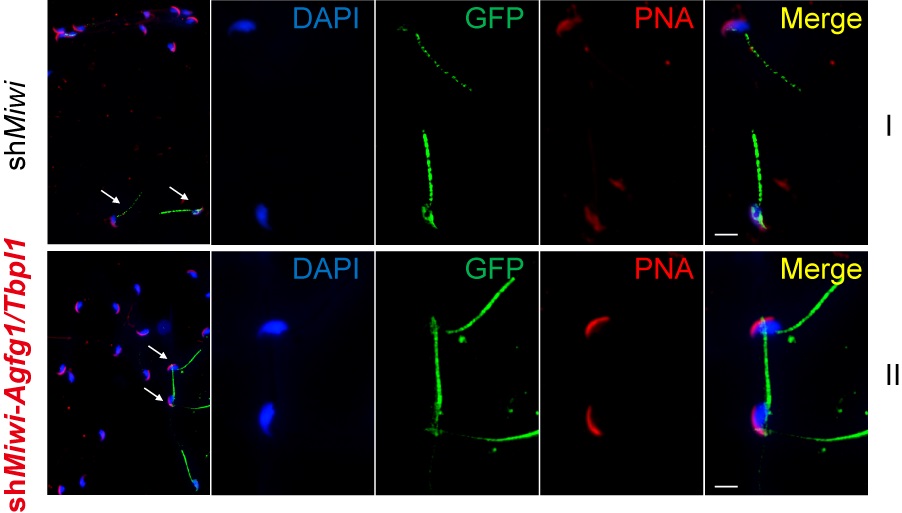
图4:恢复Miwi敲低精子细胞中Agfg1和Tbpl1的表达有效拯救了精子的顶体缺陷
这些研究结果表明,MIWI/piRNA是精子细胞中一条重要的转录后水平基因表达调控通路,有助于我们更好地了解PIWI/piRNA“机器”在精子发生中的功能机制,并为相关男性不育症的诊治提供了理论依据和方法技术。
该项研究工作由分子细胞中心刘默芳研究组与武汉大学周宇研究组、上海市计划生育科学研究所施惠娟研究组合作完成。分子细胞中心戴鹏博士、王鑫博士,美国加州大学圣地亚哥分校苟兰涛博士、分子细胞中心博士研究生李智彤、温泽和武汉大学博士研究生陈宗贵为该研究论文的共同第一作者。该研究得到国家蛋白质科学研究(上海)设施显微镜分析系统的大力支持,研究人员利用显微镜系统BD influx流式细胞分选仪分离富集小鼠精母细胞及单倍体细胞,纯化得到的细胞用于后续的qPCR 及western blot实验,以此来检测内源靶基因的表达水平,对于准确检测内源靶基因表达水平的变化提供了重要帮助。(蛋白质设施供稿)
文章链接:https://doi.org/10.1016/j.cell.2019.11.022
【1】 Klattenhoff C. and Theurkauf W. (2008). Biogenesis and germline functions of piRNAs. Development 135, 3-9.
【2】 Ozata D.M., Gainetdinov I., Zoch A., O'Carroll D., Zamore P.D. (2019). PIWI-interacting RNAs: small RNAs with big functions. Nat. Rev. Genet. 20, 89-108.
【3】 Gou, L.T., Dai, P., Yang, J.H., Xue, Y., Hu, Y.P., Zhou, Y., Kang, J.Y., Wang, X., Li, H., Hua, M.M., Zhao, S., Hu, S.D., Wu, L.G., Shi, H.J., Li, Y., Fu, X.D., Qu, L.H., Wang, E.D., Liu, M.F. (2014). Pachytene piRNAs instruct massive mRNA elimination during late spermiogenesis. Cell Res. 24, 680-700.
【4】 Zhang, P., Kang, J.Y., Gou, L.T., Wang, J., Xue, Y., Skogerboe, G., Dai, P., Huang, D.W., Chen, R., Fu, X.D., Liu, M.F., He, S. (2015). MIWI and piRNA-mediated cleavage of messenger RNAs in mouse testes. Cell Res. 25, 193-207.
【5】 Kang-Decker, N., Mantchev, G.T., Juneja, S.C., McNiven, M.A., van Deursen, J.M. (2001). Lack of acrosome formation in Hrb-deficient mice. Science 294, 1531-1533。
【6】 Zhang, D., Penttila, T.L., Morris, P.L., Teichmann, M., Roeder, R.G. (2001). Spermiogenesis deficiency in mice lacking the Trf2 gene. Science 292, 1153-1155.