
2020年4月14日,国家蛋白质科学研究(上海)设施用户北京化工大学冯越研究组在《Nature Communications》发表了题为《Structural insights into the mechanism and inhibition of transglutaminase-induced ubiquitination by the Legionella effector MavC》的研究论文(Article),报道了嗜肺军团菌一种谷氨酰胺转胺酶—MavC催化的泛素化反应及其抑制的分子机制。
蛋白质泛素化是最普遍的蛋白质翻译后修饰之一,是指泛素蛋白(Ub)在特定酶的作用下,对底物蛋白进行特异性修饰的过程,几乎参与一切生命活动的调控,与肿瘤、心血管等疾病的发病也密切相关。嗜肺军团菌是军团菌肺炎这一潜在致死性肺炎的致病微生物。基于泛素化的重要作用,嗜肺军团菌在与人类宿主细胞互作过程中,可通过多种方式调控宿主的泛素化进程。2018年,冯越研究组曾报道嗜肺军团菌SdeA介导的一种非经典泛素化的分子机制,文章发表在Nature杂志(http://news.buct.edu.cn/xysx/kxyj/99160.htm)。
MavC是另一个源于嗜肺军团菌的效应蛋白(图a),具有谷氨酰胺转胺酶活性。MavC能催化泛素分子与底物UBE2N通过异肽键交联,从而对UBE2N的K92和K94位点进行泛素化修饰,是另一种非经典的泛素化修饰,该过程可被另一种效应蛋白Lpg2149抑制。在这项最新的研究中,冯越研究组解析了MavC/UBE2N/Ub(图b)、MavC/UBE2N-Ub(图c)以及MavC/Lpg2149(图d)三种蛋白质复合物的结构。他们发现在MavC介导的新型泛素化过程中,包含UBE2N修饰位点K92的loop会发生明显构象变化以完成反应(图c),而Lpg2149通过与Ub竞争在MavC上的结合位点实现对该泛素化过程的抑制(图d)。他们同时发现MavC本身也具有针对该新型泛素化反应较弱的去泛素化能力。该研究揭示了这种由谷氨酰胺转胺酶介导的新型泛素化及其抑制的分子机制,为未来对这种修饰所引起的UBE2N活性抑制的研究以及其它催化此类反应的正、逆反应的酶的发现奠定了基础。
国家蛋白质科学研究(上海)设施BL19U1线站和上海同步辐射光源BL17U1线站工作人员为数据收集提供了及时有效的支持。
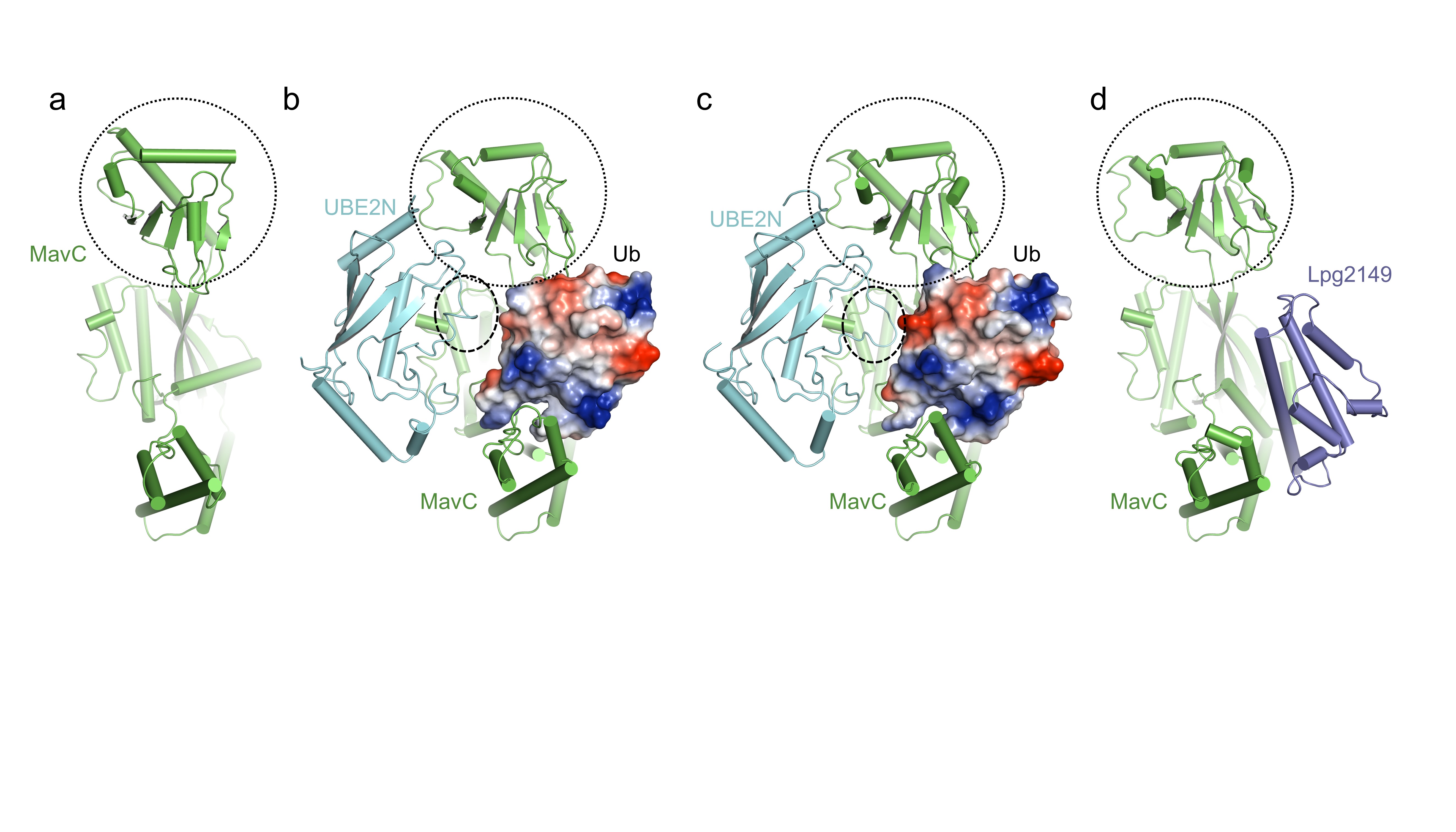
图 文章中用到及解析的蛋白质结构
MavC(a)、MavC/UBE2N/Ub(b)、MavC/UBE2N-Ub(c)以及MavC/Lpg2149(d)的结构。在所有结构中,Ub均用静电表面方式显示。MavC的插入(insertion)结构域和UBE2N的K92区域用圆圈标记
(蛋白质上海设施提供)