
蛋白质错误折叠与聚集沉淀与多种人类疾病密切相关,包括阿尔兹海默症、帕金森综合征、癌症以及II型糖尿病等。分子伴侣是帮助蛋白正确折叠、抑制蛋白聚集沉淀、介导错误折叠蛋白降解的重要因子。目前,已有多家公司正基于分子伴侣开发新型疾病治疗方法,例如近期Ranok Therapeutics公司成功开发了一种分子伴侣介导的靶向蛋白质降解技术(Chaperone-mediated Protein Degradation/Degrader, CHAMP?)以及Life Biosciences公司正在研发一种分子伴侣介导的蛋白自噬激活技术(Chaperone-Mediated Autophagy Activators)。掌握分子伴侣的作用机制,对于以分子伴侣为基础的新型疾病治疗手段的开发与优化具有至关重要的作用。
分子伴侣中平均有36.7%的氨基酸序列属于内在无序区域(intrinsically disordered regions),这些区域高度动态,目前学术界仍然缺乏对这些分子伴侣内在无序区域的详细机制解析。分子伴侣Spy是一种较为原始的折叠型分子伴侣。华东理工大学全舒教授于2011年首次确立了Spy的分子伴侣功能并解析了其晶体结构,又在2014年以Spy为研究对象阐明了分子伴侣的结构灵活性与分子伴侣活性的相关性。随后,全舒团队在2020年与2021年又分别对Spy的抗聚集沉淀机制与生理底物进行了解析与鉴定。
分子伴侣Spy具有高度无序的末端区域,占到整个蛋白序列长度的30%。此外,Spy的分子量较小、功能发挥不需要ATP及辅因子参与。这些特点使得Spy成为了研究分子伴侣内在无序区域工作机制的良好模型。2022年5月20日,华东理工大学全舒团队联合清华大学薛毅团队与国家蛋白质科学研究(上海)设施吴斌博士在Nature Communications发文,首次从动力学与结构层面对Spy的N端无序区域(1-28位氨基酸残基区域)的功能与作用机制进行了解析。作者发现Spy的N端无序区域能够动态性地同Spy的底物结合表面进行分子内相互作用,这会造成与底物蛋白的竞争,从而促进底物蛋白从Spy表面释放。该工作不但拓展了分子伴侣内在无序区域的功能,也回答了困惑领域内多年的ATP非依赖型分子伴侣如何不借助外界能量输入和明显构象变化而完成工作循环的问题。同时,Spy特殊的底物释放分子机制也将为合成生物学中的人工分子伴侣元件的设计与开发提供重要理论参考。
具体而言,作者首先发现删除Spy的N端无序区域后,Spy释放底物蛋白的速率显著降低,这表明Spy的N端具有促进底物释放的功能(图1)。随后,通过逐步删除N端无序区域的氨基酸,作者确定了N端无序区域上的D26氨基酸残基是N端发挥促进底物释放功能的关键(图1)。
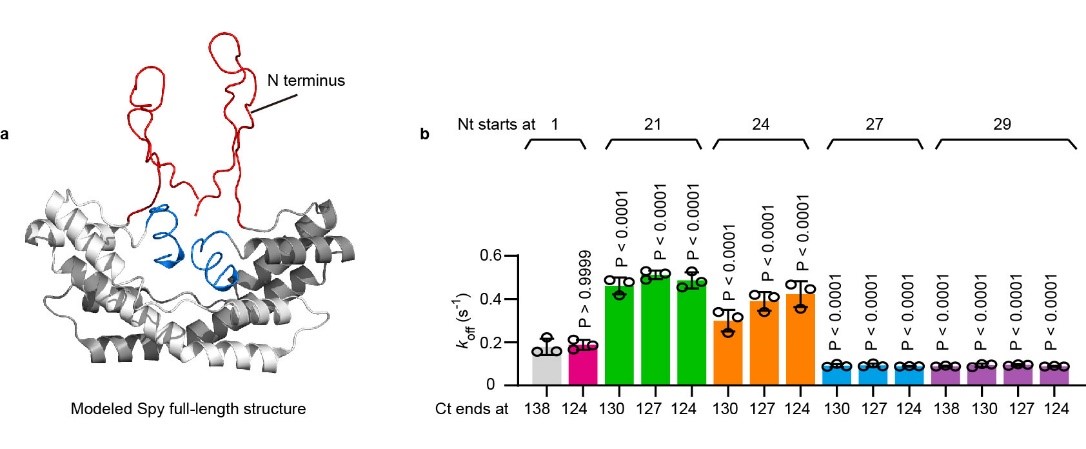
图1. Spy的N端无序区域具有促进底物释放的功能
由于Spy的底物结合表面带大量正电荷(图2a),作者猜测D26位点可能通过静电相互作用介导Spy的N端无序区域与底物结合表面进行分子内结合,从而竞争性地促进底物释放。为验证这一猜想,作者首先通过氨基酸突变对D26位点的电荷进行了变换,作者发现只有当26位点带负电时(D26/E26),N端才具有促进底物释放功能(图2b)。进一步,通过分子内顺磁驰豫增强实验与分子动力学模拟,作者表明D26位点与Spy的底物结合表面具有广泛的瞬时接触,而将D26突变为带正电的赖氨酸或精氨酸会明显减弱26位点与Spy底物结合表面的接触(图2c)。并且通过完善的突变设计,结合分子内顺磁驰豫增强实验与动力学测量,作者还鉴定到了Spy底物结合表面上参与同D26相互作用的主要氨基酸位点,即K54、R55、R61、R62与R89(图2d)。最后,通过化学位移扰动实验,作者发现底物蛋白和Spy内在无序N端在Spy主体结构区域的结合位点十分类似(图2e)。这些实验共同证明了作者的猜想,由此提出了Spy的N端无序区域工作机制(图3):即Spy的N端无序区域通过位于其上的D26残基同Spy底物结合表面上的关键正电氨基酸发生分子内静电相互作用,可有效与折叠或部分折叠的底物竞争,从而促进底物释放,整个过程高度动态。
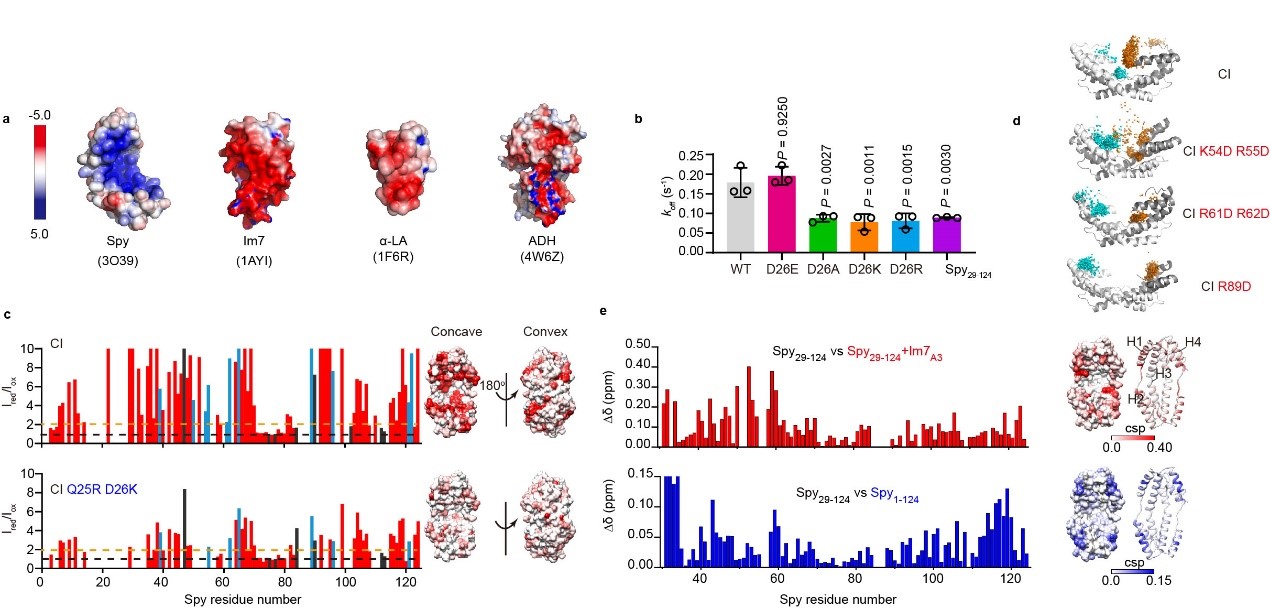
图2. N端无序区域的D26氨基酸介导N端与Spy底物结合表面的分子内相互接触
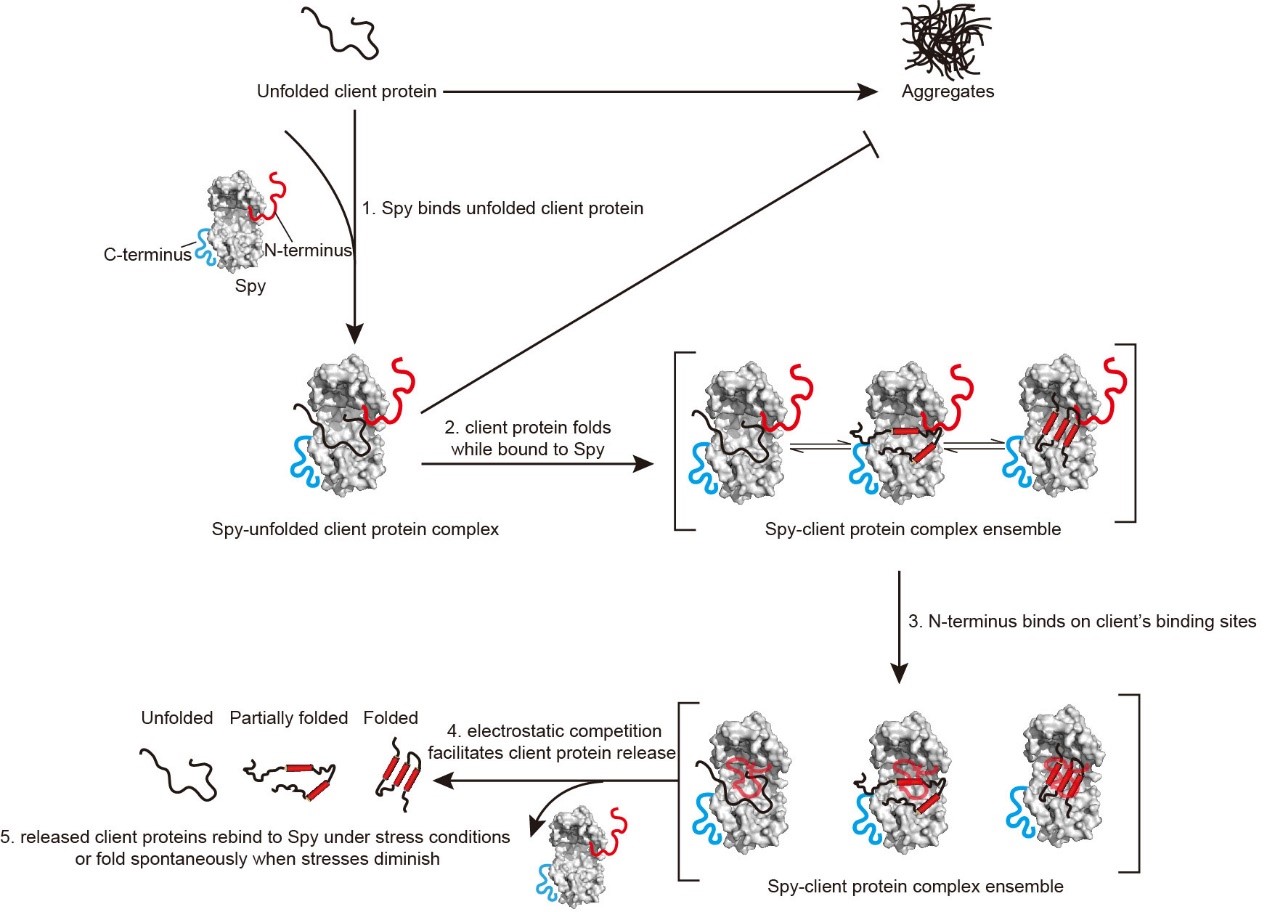
图3. 分子伴侣Spy的工作机制
该项工作应用液体核磁共振技术阐释ATP非依赖型分子伴侣蛋白的结构与作用机制。
国家蛋白质科学研究(上海)设施核磁系统用户利用高场核磁共振谱仪Agilent 800 和Agilent 600 完成表征分子伴侣Spy的N端无序区域、底物蛋白和Spy主体结构区域相互作用的化学位移扰动实验。相关的化学位移实验数据提交生物核磁共振数据库(BioMagResBank), BMRB 51107, BMRB 51108 和BMRB 51109。核磁系统薛红娟工程师参与了本项工作,为文章的共同作者。华东理工大学生物工程学院全舒教授、清华大学生命科学学院薛毅教授、国家蛋白质科学研究(上海)设施吴斌博士为本文共同通讯作者。