
由结核分枝杆菌(Mtb)引起的结核病(TB)是全球最致命的传染病,数千年来一直对人类健康构成严重威胁1。Mtb每年在全世界造成约1040万新发结核病例和约140万例死亡。耐药性Mtb的日益流行进一步加剧了对新型抗分枝杆菌药物的需求2。
RNA加工和降解是细菌RNA稳态维持所必需,也是新型抗菌药物发现的潜在靶点3。核糖核酸酶(RNases)负责RNA代谢。细菌通过这一过程调节特定基因的表达,以快速适应生长环境的变化。不同物种间mRNA降解复合物(degradosome)具有显著差异,其中RNase J是Mtb降解复合物的重要组成部分,在调节细菌生长和生存中起着至关重要的作用4,5。但目前尚无结核分枝杆菌来源RNase J的结构信息报道,相关酶活机制也不清楚。
2023年4月20日,国际学术期刊Nature Communications在线发表了复旦大学生命科学学院李继喜教授和张雪莲副教授团队及中科院植物生理生态研究所赵国屏院士团队的合作研究成果“Structural insights into RNase J that plays an essential role in Mycobacterium tuberculosis RNA metabolism”。

李继喜课题组长期从事病原体感染-宿主免疫应答研究工作。近期已经成功解析了结核分枝杆菌核糖体延伸因子EF-Tu/EF-Ts复合物(Zhan et al. Commun Biol, 2022)6以及Mtb潜伏感染关键分子MazG(Wang et al. Front Biol, 2023)7的三维结构,筛选到多个调控Mtb生长的抑制性小分子化合物。
在本研究中,研究团队首次解析了结核分枝杆菌核酸酶RNase J的处于apo状态及其与7-nt RNA结合的复合物三维结构。发现Mtb-RNase J使用锌离子进行双金属离子催化,形成具有Asp81,Asp85,His86,His148,His170和His397残基的活性口袋。金属离子Mn2+通过增加Mtb-RNase J对RNA底物的亲和力,显著增强其核酸酶活性。在耻垢分枝杆菌中敲除RNase J会极大改变菌落形态、生长速率及RNA代谢途径相关基因的表达水平;RNA-seq分析及进一步的回补实验证实RNase J对于分枝杆菌的RNA代谢至关重要。相关工作为抗结核药物的研发提供了新的视角。
基于一级序列同源性比对,RNase J归属于β-CASP 家族的金属β-内酰胺酶,具有水解β-内酰胺抗生素的活性,是目前在原核生物体内发现的唯一一个同时具有5’ - 3’ 外切酶和内切酶双功能活性的细菌核糖核酸酶。首先,研究人员纯化了Mtb-RNase J,使用头孢硝噻吩(nitrocefin)测定了Mtb-RNase J的β-内酰胺水解酶活性,使用人工合成的5’末端FAM标记的20 nt- RNA作为底物,测定了Mtb-RNase J的外切酶活性。经EDTA螯合处理后,Mtb-RNase J的催化活性降低了61%,表明二价金属离子参与了RNA的水解过程。此外,分别比较5 mM浓度的二价金属离子对其核酸外切酶活性的影响,结果显示Mtb-RNase J对金属离子具有很强的选择性,Mn 2+与Mg2+具有激活的功能,能够提高其催化活性,而过量的Zn2+与Ca2+会抑制其活性(图1)。
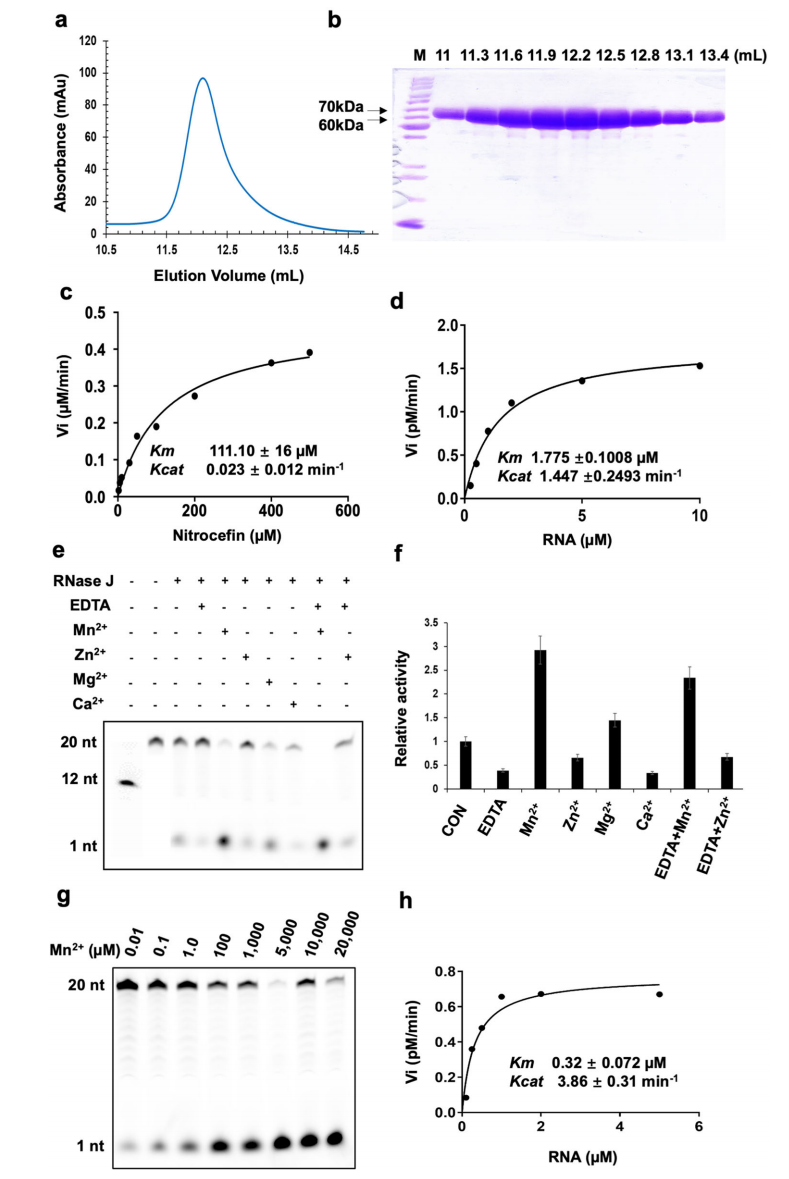
图1 二价金属离子影响结核分枝杆菌RNase J的β -内酰胺酶活性
通过异源表达纯化及晶体结构解析,研究人员获得了Mtb-RNase J apo及RNA结合状态下的三维结构。Mtb-RNase J apo结构包含 β-lactamase 结构域、β-CASP结构域和C-terminus结构域三个主要结构域,活性中心含有两个Zn2+离子,位于β-lactamase与β-CASP两个结构域的狭缝内。β-lactamase(R5-205,R376-450)结构域是Mtb-RNase J的核心催化结构域,两对反向平行的分别由7个β折叠片平行排列形成的结构组成结构域核心,β折叠片两侧分别有三个α螺旋,共同组成三明治结构。β-CASP结构域(R210-374)形成经典的α/β折叠桶结构,5个β折叠片平行排列在折叠桶的中心,六个α螺旋位于折叠片的两侧。C末端结构域(471-553) 通过一个α螺旋与β-lactamase结构域相连,与Mtb-RNase J核心结构域(β-lactamase与β-CASP)距离较远。虽然apo结构显示一个异构单元中包含一个分子,但无论是凝胶过滤层析还是小角散射数据都显Mtb-RNase J在溶液中为有活性的二聚体形式(图2)。
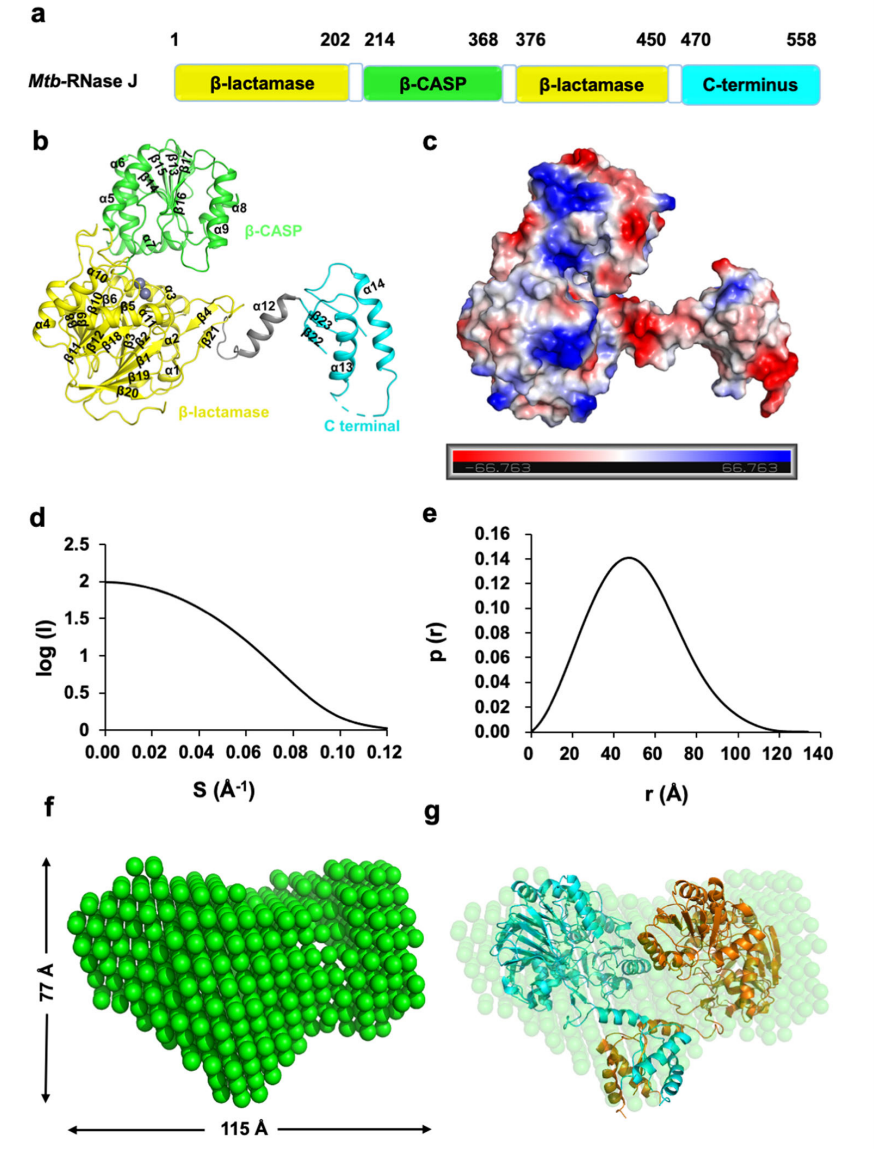
图2 Mtb-RNase J的整体结构及与小角散射数据的拟合
Mtb-RNase J与7 nt RNA的复合物结构显示一个异构单元里有两个分子,ssRNA位于β-内酰胺酶和β-CASP结构域的界面。将Mtb-RNase J/RNA复合物结构与其apo结构进行比对发现其构象变化很小,而将Mtb-RNase J复合物结构与嗜热菌Tth-RNase J apo结构进行比对发现其底物结合通道附近有较大的构象变化。α3和α7分别向通道两边扩张,α8以及α8和β15之间的loop(R305-313)也都偏离底物结合通道,这些构象变化均使得底物结合通道处于打开的状态,有利于底物的结合。此外,Mtb-RNase J复合物结构中,RNA结合区域主要为正电荷,而与RNA结合通道正对着的两段序列R46-64与R440-450显示为较强的负电荷,这为底物的结合提供了一个强有力的极性环境,可确保底物牢牢与酶结合(图3)。
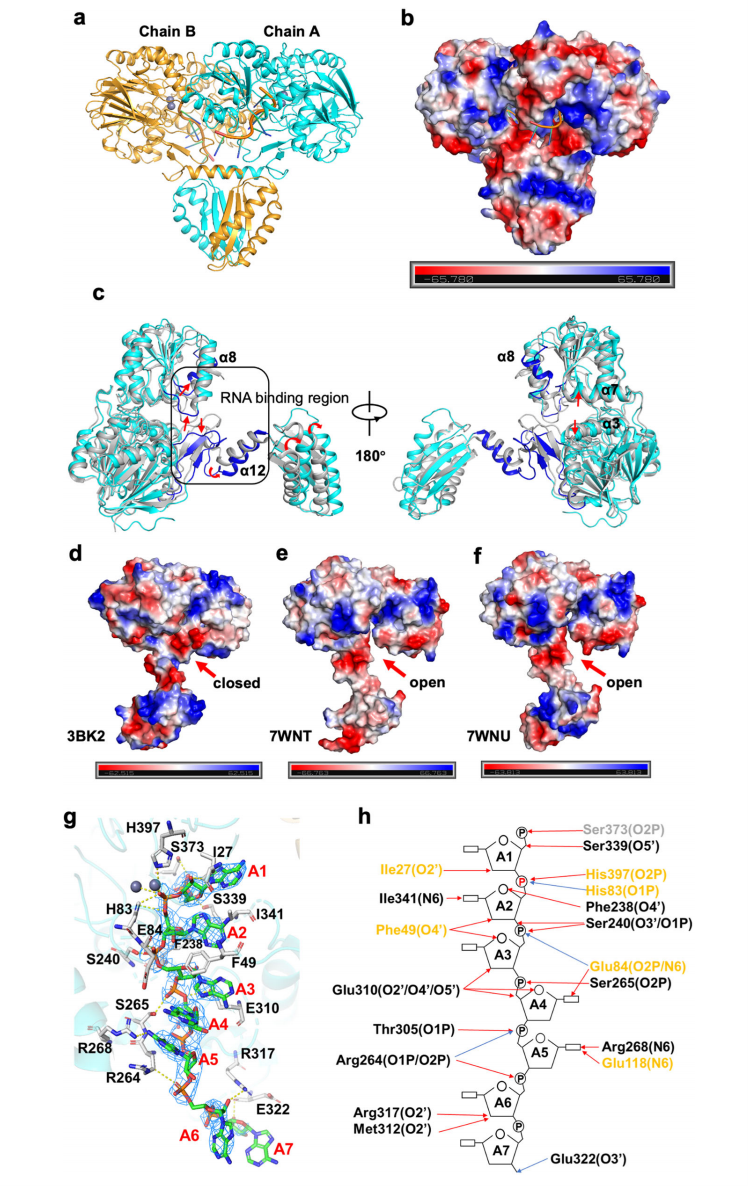
图3 Mtb-RNase J/ssRNA复合结构及其与Tth-RNase J结构比对
Mtb-RNase J的活性中心位于β-内酰胺酶和β-CASP结构域之间的深裂缝中,由两个八面体配位的锌离子组成。此外,在活性中心发现了一个水分子,用于连接两个锌离子,与Asp85和His83的侧链形成氢键。一个锌原子(命名为Zn-1)与残基His81,His83和His148配位,另一个锌原子(命名为Zn-2)与残基Asp85、His86和His397相互作用。序列比对表明这些配位残基在RNase J家族中高度保守。此外,这些残基的丙氨酸取代严重抑制了Mtb-RNase J的核酸酶活性(图4)。表明酶促反应需要锌的精确配位,锌在催化过程中最有可能起到稳定活性中心结构的作用。
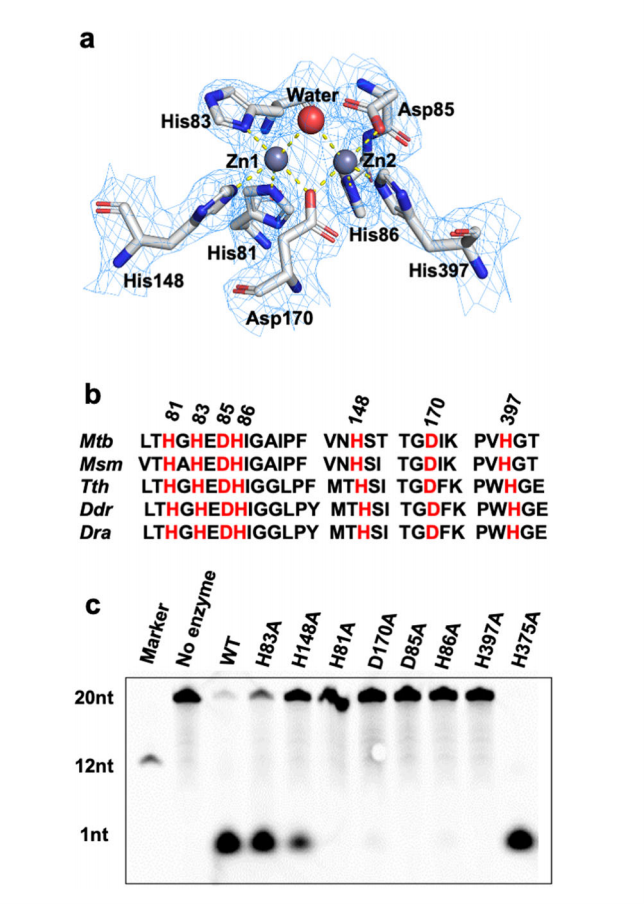
图4 Mtb-RNase J的活性位点
为了研究RNase J的生理功能,研究人员以耻垢分枝杆菌为模型生物,通过同源重组方法构建了耻垢分枝杆菌RNase J敲除菌株,并将敲除菌株与野生型菌株的生长速率、菌株形态和转录组进行了比较。与野生型(WT)菌株相比,RNase J敲除型(KO)菌株在液体培养中的生长速度较慢,且KO株的平板菌落尺寸明显小于WT株,分枝杆菌细胞长度明显长于WT株;而回补株(Com)明显改善敲除引起的生长形态(图5)。这些表观数据揭示RNase J可能影响分枝杆菌细胞膜和细胞壁的合成,从而影响其菌落形态。
通过RNAseq比较RNase J敲除型与野生型耻垢分枝杆菌的转录组,发现与WT株相比,以p值<0.05和|log2FC|>1为临界值,敲除菌株中有349个差异表达基因,其中8个显著上调,341个显著下调。差异表达基因中,KEGG分析发现49个基因集中在代谢途径中。特别是细胞膜和细胞壁相关成分蛋白的基因受到了显著的调控(图5)。这进一步说明RNase J可能通过调节脂质代谢来影响分枝杆菌细胞膜和细胞壁的生理合成,并在一定程度上影响分枝杆菌菌株的毒力。
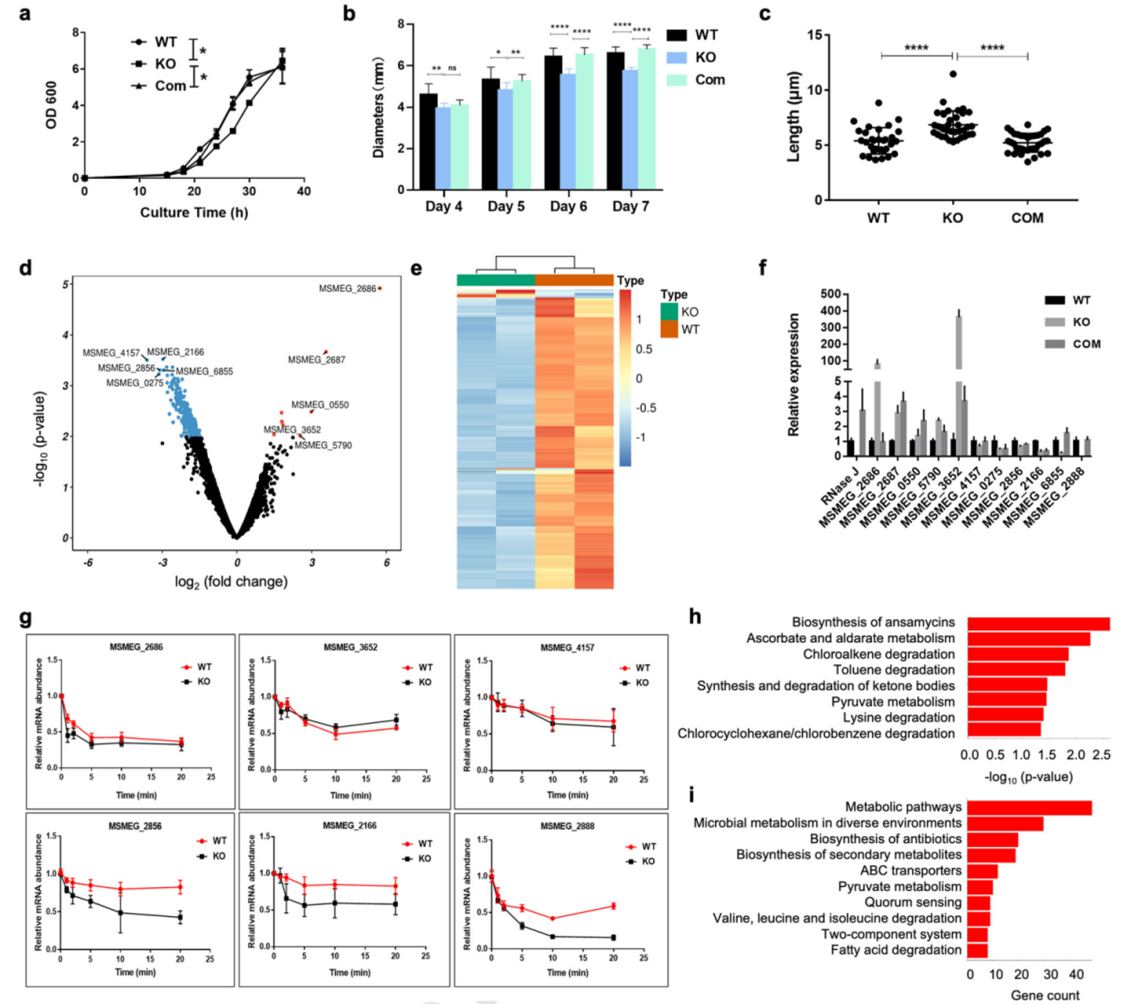
图5 RNase J基因敲除对耻垢分枝杆菌生长速率、菌株形态和转录组的影响
综上,该研究以Mtb-RNase J为研究对象,从酶学性质、三维结构以及生理功能三个方面具体分析了Mtb-RNase J参与RNA代谢调控的结构基础与分子机制,探究了RNase J对分枝杆菌生理功能的影响。这些发现细致地解析了Mtb-RNase J的三维结构并阐述了RNase J对分枝杆菌属生理功能的重要影响,可能为结核病的药物治疗提供一个很有希望的靶点。
参考文献
1 Lalvani, A. & Pareek, M. A 100 year update on diagnosis of tuber-culosis infection. Br. Med Bull. 93, 69-84 (2010).
2 Fojo, A. T. & Dowdy, D. W. Multidrug-resistant tuberculosis in India: looking back, thinking ahead. Lancet Public Health 2, e8-e9 (2017).
3 Liu, Y. et al. NapM, a new nucleoid-associated protein, broadly regulates gene expression and affects mycobacterial resistance to anti-tuberculosis drugs. Mol. Microbiol. 101, 167-181 (2016).
4 Hicks, N. D. et al. Clinically prevalent mutations in Mycobacterium tuberculosis alter propionate metabolism and mediate multidrug tolerance. Nat. Microbiol. 3, 1032-1042 (2018).
5 Zhang, H. et al. Genome sequencing of 161 Mycobacterium tuber-culosis isolates from China identifies genes and intergenic regions associated with drug resistance. Nat. Genet. 45, 1255-1260 (2013).
6 Zhan, B. et al. Structural insights of the elongation factor EF-Tu complexes in protein translation of Mycobacterium tuberculosis. Commun. Biol. 5, 1052 (2022).
7 Wang, S. et al. Structural analysis of the housecleaning nucleoside triphosphate pyrophosphohydrolase MazG from Mycobacterium tuberculosis. Front. Bio. 14, 1137279(2023).
设施贡献
本研究中X射线晶体衍射数据(PDB ID:7WNU)在BL18U1、BL19U1收集,小角散射数据在BL19U2生物小角线站收集,国家蛋白质科学研究(上海)设施线站人员为该工作提供了重要技术支持和机时保障。