
2025年1月10日,中国科学技术大学项晟祺教授课题组,侯中怀教授课题组和姚雪彪教授课题组在《Nature Chemical Biology》期刊在线发表了题为“The molecular mechanism of temperature-dependent phase separation of heat shock factor 1 ”的研究论文。该研究首次发现了热休克转录因子1(HSF1)通过相分离传导温度调控效应。研究团队综合利用生物化学、核磁共振波谱学、统计物理和分子动力学模拟等多学科手段,成功解析了HSF1编码温度响应能力的化学代码,阐明了翻译后修饰对其活性的调控机制,并揭示了不同物种HSF1序列差异与其生理体温之间的关联。这一突破性发现为理解HSF1的温度感知机制提供了全新的分子视角。

HSF1是热休克应答反应(HSR)的核心调控因子,能够快速感知温度变化并诱导分子伴侣等基因的表达,从而维持细胞内蛋白质稳态。HSF1的活性受到翻译后修饰(PTMs)的精确调控,这些修饰影响其相分离能力及下游基因的转录。这种精细的热休克应答反应不仅对细胞的即时生存和长期环境适应至关重要,还与多种疾病的发生发展密切相关。
本研究率先揭示了HSF1具有温度依赖性相分离特征, 并发现不同物种HSF1的相变临界温度与其各自的生理体温高度一致,表明HSF1本身可作为就一个细胞内的天然“温度计”。研究进一步鉴定出HSF1中的天然无序区域——调节结构域(RD)是其感知温度和驱动相分离发生的核心功能模块,而相邻的亮氨酸拉链结构域主要发挥调节作用。RD内不同的翻译后修饰可显著改变其相分离行为。平均场模型对相图的拟合分析显示,野生型HSF1具有典型的低临界溶液温度(LCST)相分离特征。
SAXS技术的应用
蛋白质氨基酸主链的聚集状态和尺寸分布与其相分离能力密切相关。本研究中,项目团队采用小角X射线散射技术获得了单体 RD 结构域在 5 °C 和 37 °C 的稀溶液中尺寸分布,,结果表明,野生型RD(WT)和突变体RD(M1 和 M2 ) 回转半径 (Rg) 大小有显著差异,在 5 °C 时WT蛋白Rg 为49.9 ?、而突变体蛋白Rg分别为36.1 ? 和 56.3 ?,这与它们的相分离能力一致。此外,WT 蛋白的分子体积表现出温度依赖性变化,当温度从 5 °C 升高到 37 °C 时,WT蛋白Rg从 49.9 ? 降低到 34.6 ?。 相比之下, M1 和 M2 蛋白Rg随温度升高变化并不显著,在 37 °C 时突变体蛋白Rg分别为 32.7 ? 和 50.3 ?。
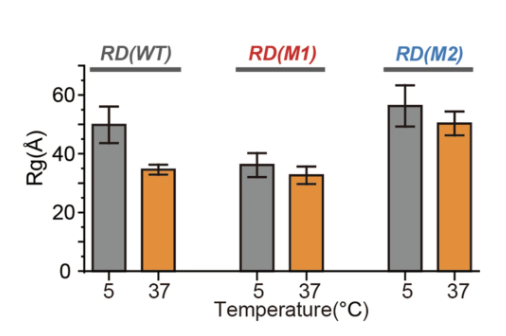
图 在 5 °C 和 37 °C 下用 SAXS 测量 WT RD 、 M1 和 M2 突变体的 Rg 值。 在每个温度下,对于每个样品,收集一组 20 条样品曲线及其相应的 20 条缓冲曲线。该软件通过对 20 条样本曲线进行平均,然后减去平均背景曲线以消除任何基线效应来处理这些数据。随后,通过多次 Guinier 拟合计算平均回转半径 (Rg) 及其相关误差。
本研究对HSF1的相分离机制进行了全面的分析,并确定了解释物种生理的HSF1的物种特异性温度代码,为相分离的温度传感提供了新的见解。
研究相分离的物理学特性、形成机制、生物学功能是目前该领域的重点。SAXS 的溶液样品环境为研究相分离提供了条件,可以方便的研究各种因素(如溶剂、盐浓度、pH 值、温度等)对生物大分子聚集体的影响, 快速的获取包括粒子的尺寸、形状及其分布;粒子分散状态;粒子与介质的界面结构和相分离程度等结构参数。
原文链接:https://doi.org/10.1038/s41589-024-01806-y