
2017年7月26日,国家蛋白质科学研究(上海)设施核磁分析系统用户复旦大学生物医学研究院温文玉课题组在EMBO reports杂志上在线发表题为“AllostericAuto-inhibition and Activation of Nedd4 family E3 ligase ITCH”的研究论文,利用X射线晶体学及NMR方法解析了该家族成员Itch的自抑制结构,并进一步揭示了其酶活性调控及激活机制。
Nedd4家族E3泛素连接酶是HECT型泛素连接酶中最大的一个家族,它们是细胞生长、增殖的重要调节蛋白,其酶活性的失调与许多癌症和疾病密切相关。Nedd4家族成员由于分子内相互作用而使其自身的酶活性受到抑制,但整个家族成员的酶活性调控机制尚不清楚。该课题组研究工作发现Itch的WW2结构域及随后的一段Linker(L,连接区)直接结合在HECT结构域上,并通过变构效应抑制E2-E3的泛素转移过程。结合接头蛋白(如Ndfip1)或者JNK1介导的PRR区域磷酸化可以激活Itch,这两种激活方式都依赖于结合WW2从而释放出HECT结构域。进一步研究发现,异常激活的Itch会引起神经发育过程中大脑皮层神经元迁移缺陷。
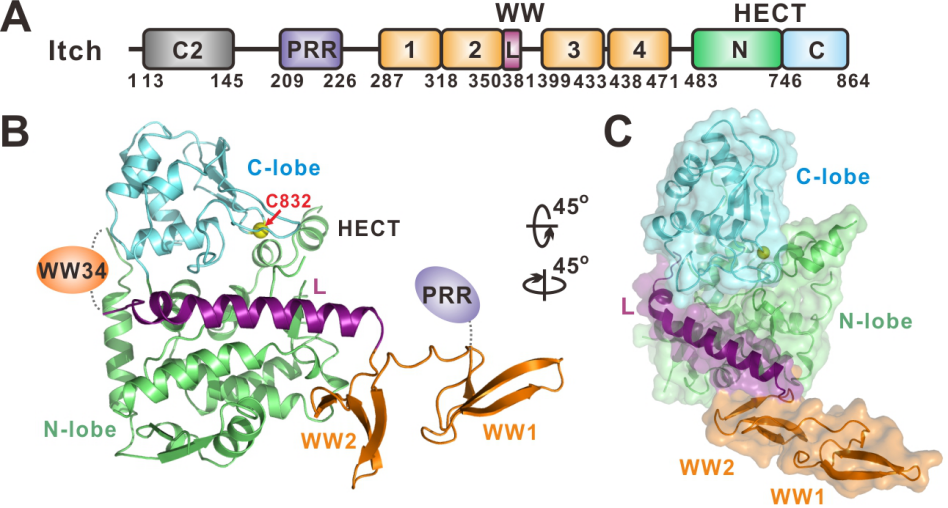
图A: Itch分子结构示意图; B:Itch∆C2(143-864)蛋白整体结构飘带图; C:ITCH∆C2143-864蛋白结构表面图。
同期,约翰霍普金斯大学的Philip A. Cole教授课题组在Mol Cell上发表文章,揭示了Nedd4家族另一成员WWP2的自抑制结构,与该Itch自抑制结构非常相似。不同的是,Philip A. Cole课题组强调了基于Linker的活性调控及激活机理,而温文玉课题组则探讨了Nedd4家族保守的WW结构域对于HECT的调节,两种机制相互补充。这项工作为理解Nedd4家族的活性调控机理,以及Nedd4家族成员失调相关疾病的药物设计提供了结构基础。
该研究得到了国家973计划及国家自然科学基金的支持。上海光源线站BL17U1以及蛋白质上海设施核磁分析系统安捷伦800M谱仪为本课题的顺利开展提供了重要的保障,平台管理和服务人员提供了关键的技术支持。
论文连接:https://www.ncbi.nlm.nih.gov/pubmed/28747490
(上海设施提供)