
2022年4月13日,国家蛋白质科学研究(上海)设施用户山东大学于晓、孙金鹏及其合作团队在Nature杂志上在线发表了题为Tethered peptide activation mechanism of the adhesion GPCR ADGRG2 and ADGRG4的研究论文。该研究阐明了粘附类G蛋白偶联受体(Adhesion G Protein-coupled receptor,aGPCR)依赖Stachel激活的通用作用机制,并创新性发展了粘附类GPCR的多肽激动剂和拮抗剂,为精准靶向粘附类GPCR配体的设计和开发奠定了基础。
与GPCR家族其他成员相比,aGPCR具有显著的结构特征,包括复杂的多结构域的N端胞外区域(Extracellular region)以及可以发生自水解的GPCR蛋白酶自水解诱导(GPCR autoproteolysis-inducing, GAIN)结构域,其中包含保守的GPCR水解位点(GPCR proteolysis site,GPS)。绝大多数aGPCR成员可以自发在GPS位置发生自水解,产生α和β两个亚基,其β亚基最N端的区域被称为Stachel序列(德文中的“针刺”)。研究表明aGPCR可以感受外界多种不同信号刺激而具有截然不同的激活模式,例如可以被细胞内液体流动或者震动等机械力激活,被可溶的小分子或者蛋白配体激活等。
除小分子配体直接激活之外,目前认为aGPCR与Stachel相关的激活主要分为三种模式(图1)。
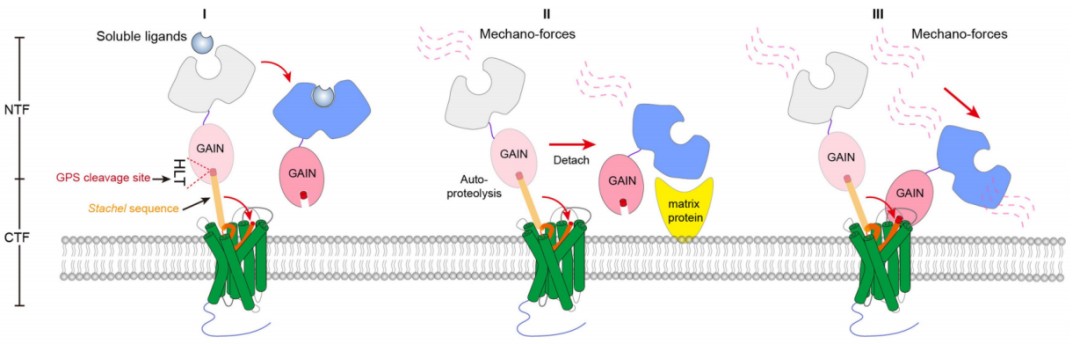
图1. aGPCR与Stachel序列相关的激活模式
Stachel序列引起的粘附类GPCR激活作用一直是粘附类GPCR信号和功能的核心内容,然而Stachel序列如何与受体作用,调控受体激活状态的通用机制仍未明晰。本研究通过冷冻电镜技术解析了Stachel序列激活的ADGRG2-β-Gs和ADGRG4-β-Gs复合物结构,揭示了Stachel序列与aGPCR的直接作用机制,发现了5个疏水氨基酸呈手指状分布,在Stachel序列介导的激活过程中起到了主要作用,因此提出了aGPCR激活的“finger”模型激活模式,并命名为手指模型。
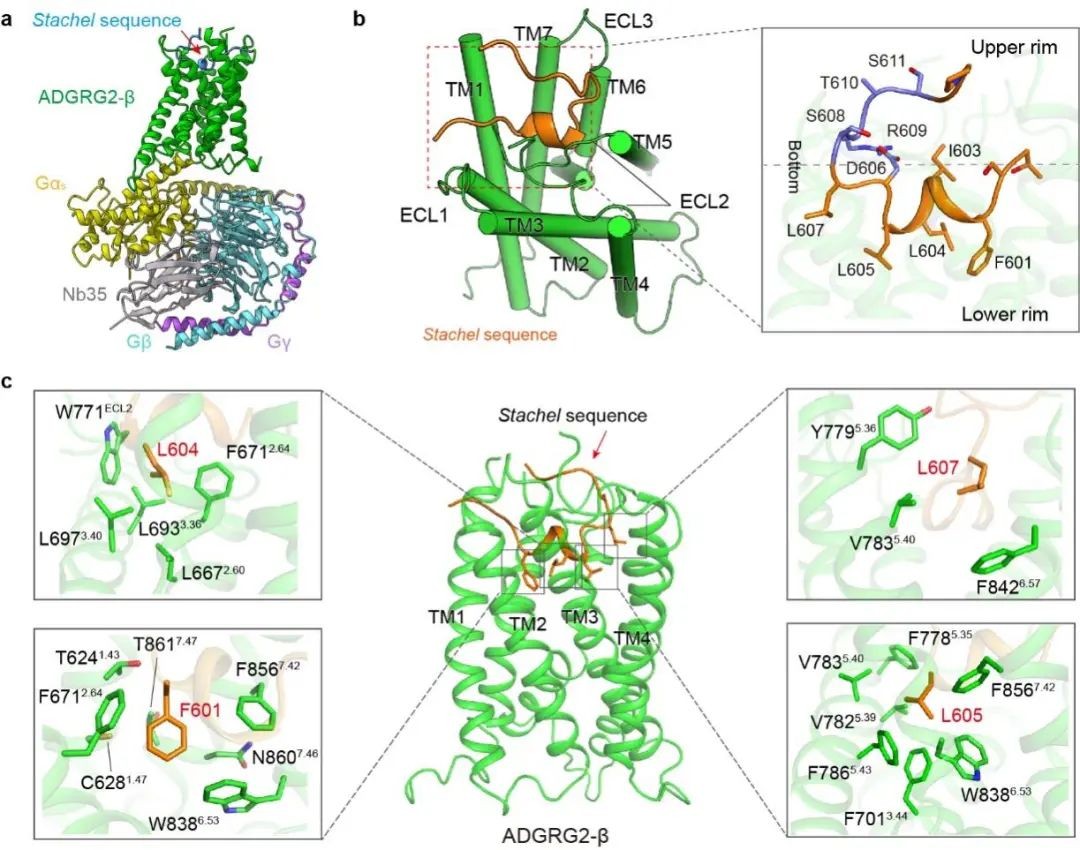
图2. Stachel序列与ADGRG2的相互作用模式。a. Stachel序列激活的ADGRG2-β-Gs复合物结构模型。b. Stachel序列成“U”型构型结合于ADGRG2七次跨膜螺旋形成的口袋中,并且沿底部开口方向分割为极性亲水的上半部分和疏水的下半部分。c. Stachel序列的疏水部五个疏水氨基酸指状形式和位置与受体五个疏水口袋直接相互作用。
目前关于aGPCR家族的拮抗剂报道甚少,制约着aGPCR家族功能的研究和相关靶向药物的开发。利用新开发的激动剂VPM-IP15,在W6.53附近的三个“手指”残基做了一系列突变(图3)。这种通过多肽激动剂进行负电改造获得多肽拮抗剂的策略,如同在激活的手指模型的食指上带了个戒指,决定性地改变了粘附类受体多肽地功能。此方法在ADGRG4、ADGRG5和ADGRG6中也同样适用。本研究针对Fss03进行极性改造,开发了一种aGPCR家族拮抗性短肽配体的通用改造方法,将极大推动aGPCR家族多肽拮抗剂发展。
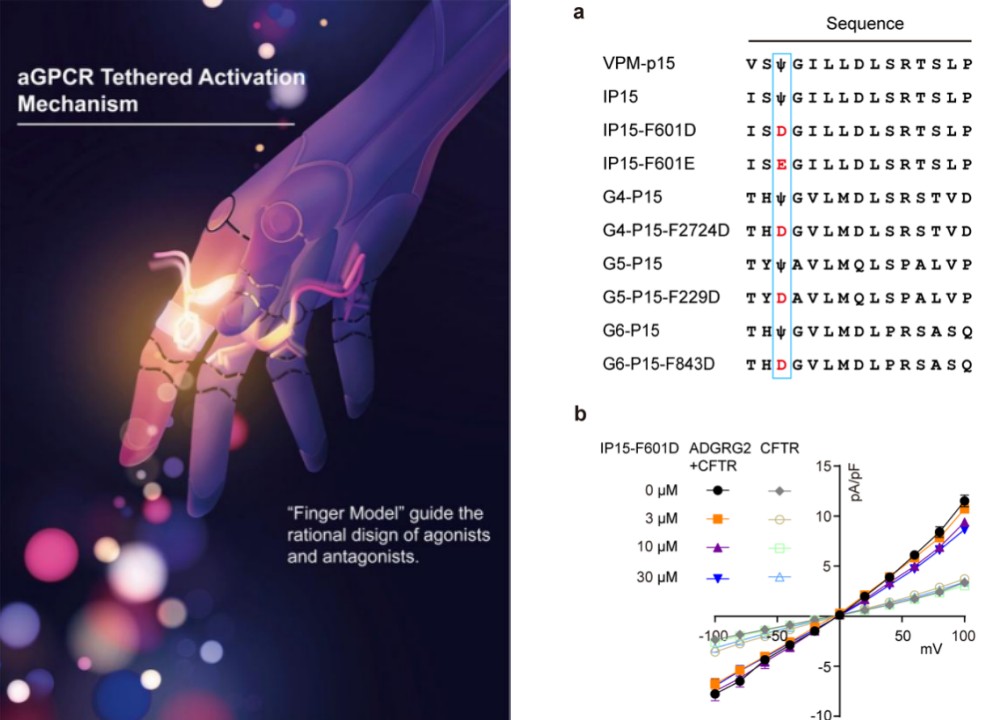
图3. 发展aGPCR通用的肽拮抗剂改造策略。a.Stachel肽基激动剂和拮抗剂的序列比对。通过Fss03突变为Dss03或Ess03,用蓝色框标出。Ψ: 4-MeF。b. Stachel肽基拮抗剂F601D和F601E影响ADGRG2介导的CFTR电流响应。
综上所述,本研究详细阐明了aGPCR自激活的分子机制,根据所观察到的Stachel基序激活机制,提出了aGPCR激活的手指模型,并在这个模型的基础上,发展了aGPCR多肽激动剂/拮抗剂设计的通用方法, 尤其是通过给手指戴戒指就可以把激动剂改为拮抗剂。此工作对靶向aGPCR的配体药物研发有重要的参考价值和指导意义。
国家蛋白质科学研究(上海)设施电镜分析系统孔亮亮、王芳芳等为该研究的冷冻样品制备、样品筛选、电镜数据收集及数据前处理工作,提供了技术支持。