
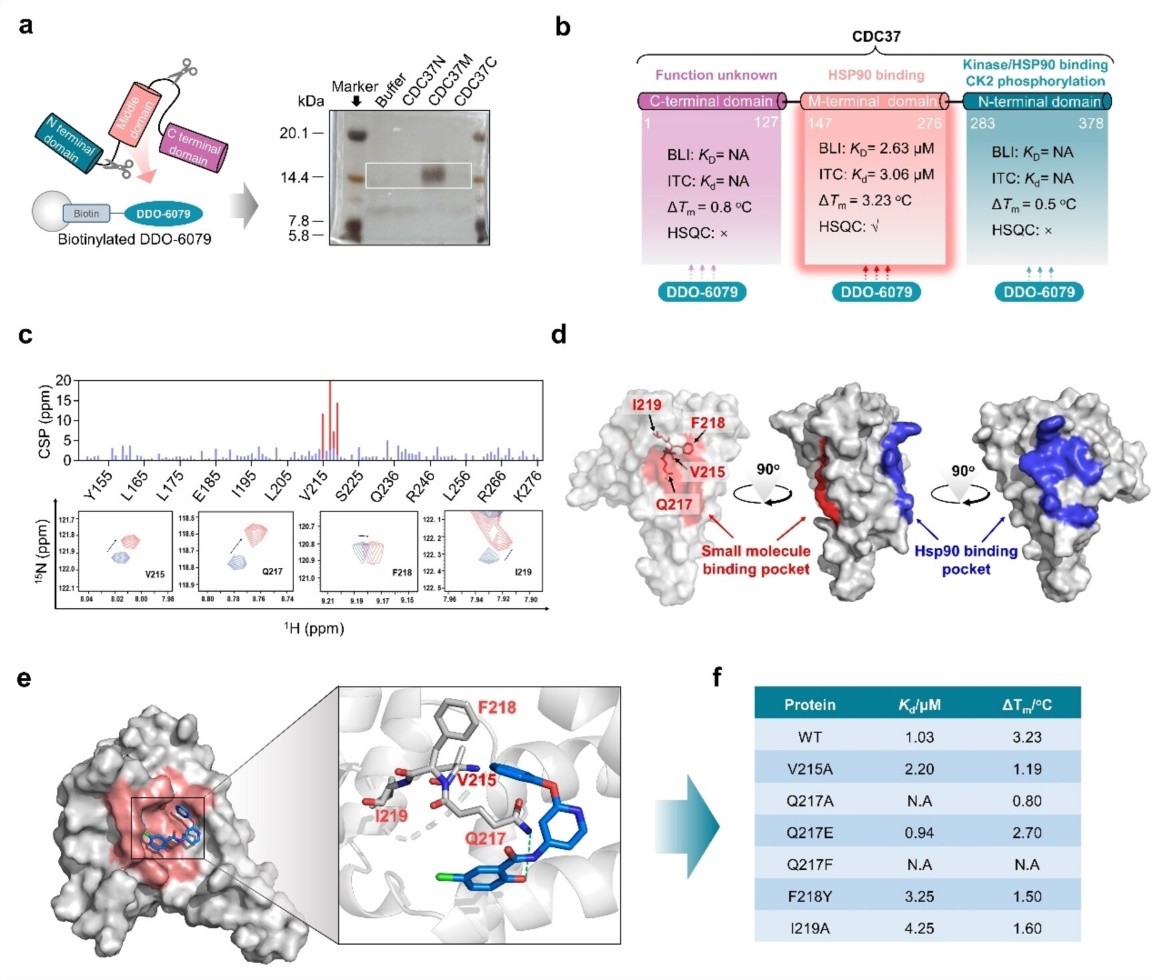
图1. NMR技术发现DDO-6079 结合在CDC37M端结构域的变构位点。
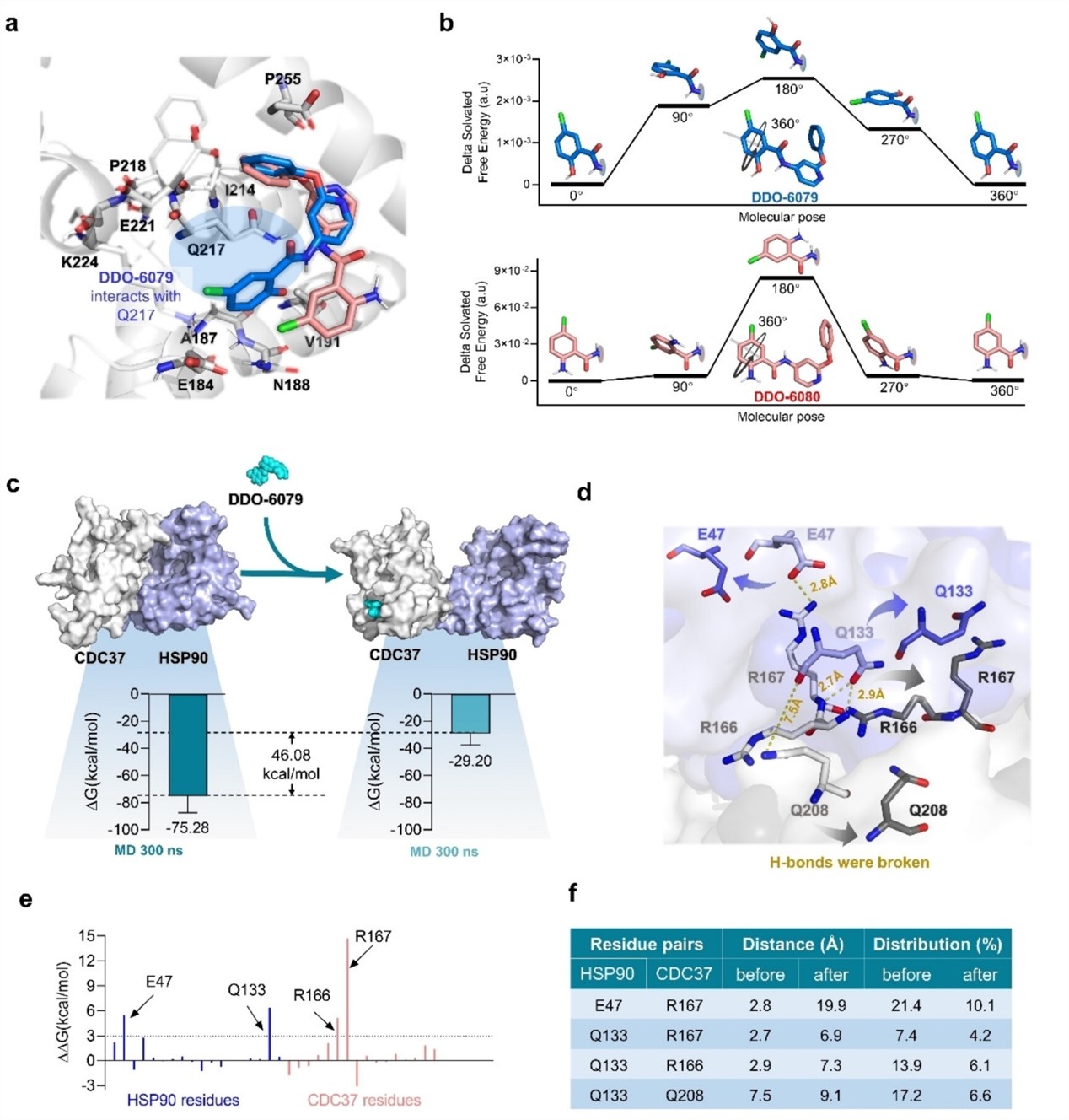
图2. CDC37抑制剂的变构作用机制
多种免疫共沉淀实验表明,DDO-6079可在低微摩尔浓度范围内可同时阻断CDC37-HSP90和CDC37-CDK4/6相互作用。进一步通过蛋白质组学分析CDC37和HSP90的代表性客户蛋白,发现与对照组相比,治疗组中的激酶蛋白(如CDK4/6、Raf和AKT等)受到抑制,而非激酶蛋白不受影响。同时,与HSP90 ATP酶抑制剂AT13387相比,DDO-6079对热休克反应(HSR)相关蛋白(HSF-1、HSP70、HSP40和HSP27)无影响,显示出较好的安全性。在对CDK4/6抑制剂敏感和耐药的细胞系中进行抗肿瘤细胞增殖实验时,结果显示帕博西尼(Palbociclib,CDK4/6抑制剂)对其耐药的HCT116和SW620细胞几乎无抑制作用,而对敏感的MCF-7和T47D细胞具有纳摩尔级的抗增殖活性。将DDO-6079与Palbociclib联合使用可逆转HCT116细胞的耐药性,使其活性恢复到低纳摩尔范围。进一步的机制探索表明,DDO6079可以通过靶向CDC37抑制CDK4/6的成熟,并降低CDK6蛋白的热稳定性,进而恢复CDK4/6抑制剂在耐药细胞中的敏感性。以上研究探索了小分子靶向CDC37对激酶成熟调控的作用机制和逆转激酶耐药的治疗学应用。
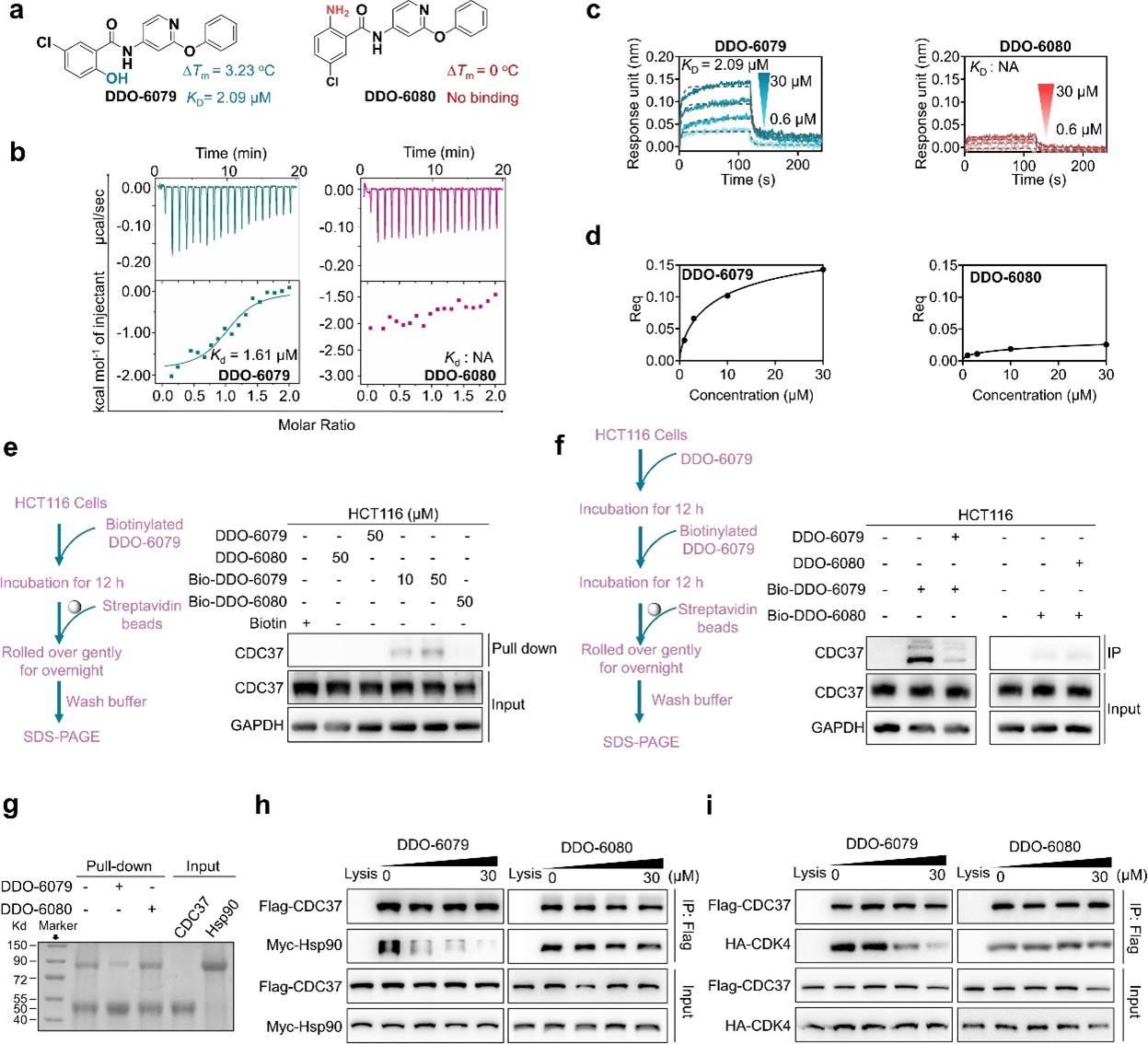
图3. DDO-6079抑制剂阻遏 HSP90-CDC37-CDK4 复合物的形成
在该项工作中,中国药科大学的张立晓,刘伟,张秋月和何彦仪与上海交通大学医学院的郑振为论文的共同第一作者。王磊,尤启冬,张健,张连山为通讯作者。项目得到了科技部BT-IT重点研发计划、国家自然科学基金委、江苏省自然科学基金、中国药科大学高层次青年人才等项目的资助。
本项目先期尝试复合物晶体结构解析未成功后,在国家蛋白质科学研究(上海)设施核磁分析系统的Agilent800和Bruker900液体核磁谱仪上先收集了多套数据,并结合突变等其它实验,最终确认DDO-6079 与 CDC37M 结合诱导多个氨基酸残基发生化学位移(尤其是 V215、0217、F218 和I219),这些氨基酸组成的结合口袋位于 CDC37 和 HSP90 结合界面的' 背面”,揭示了全新的变构调控机制。
全文链接:DOI: 10.1002/anie.202413618