帕金森病(Parkinson's Disease, PD)是一种进展性神经退行性疾病,主要损害中脑多巴胺神经元。随着全球人口老龄化,PD患者的数量持续上升。目前,PD的治疗主要依赖多巴胺替代疗法,虽然可以暂时缓解症状,但无法阻止疾病进展。因此,深入研究PD的复杂病因机制,发现新的治疗靶点并开发更为有效的治疗方案是当前PD治疗研究的关键。
中国科学院上海有机化学研究所的生物与化学交叉研究中心刘聪团队、复旦大学附属华山医院的郁金泰团队以及复旦大学脑科学转化研究院的袁鹏教授团队合作,在Science杂志上发表了题为“Neuronal FAM171A2 mediates α-synuclein fibril uptake and drives Parkinson’s disease”的研究文章。该研究确定了神经元膜上的受体蛋白FAM171A2在介导摄取PD病理性蛋白α-synuclein(α-syn)淀粉样纤维中的作用,并筛选出能够阻断α-syn淀粉样纤维与受体结合的小分子化合物,为PD治疗提供了新的靶点和药物开发的新方向。

研究人员确定了FAM171A2作为PD风险基因,参与PD病理进程发展。在细胞和PD模型小鼠中敲低FAM171A2蛋白会减少神经元对α-syn淀粉样纤维的摄取,减缓PD病理发展;而过表达FAM171A2蛋白的PD模型小鼠表现出更严重的多巴胺能神经元丢失和行为缺陷。
为了探究FAM171A2蛋白与α-syn蛋白互作的具体分子机制,研究人员依托国家蛋白质科学研究(上海)设施核磁系统Agilent 800 MHz仪器,对 FAM171A2蛋白和15N同位素标记的α-syn蛋白进行了核磁滴定实验。HSQC谱图显示15N-α-syn的羧基末端区域发生显著化学位移变化,揭示α-syn主要通过其负电富集的羧基末端区域与FAM171A2蛋白发生相互作用(图1)。
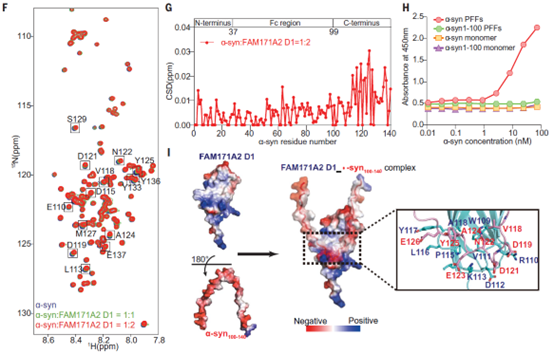
图1. 核磁滴定实验揭示FAM171A2蛋白与α-syn蛋白互作为点(F, G)
进一步地,研究人员基于体外实验结果,通过人工智能的蛋白结构预测和高通量虚拟筛选技术,得到抑制FAM171A2与α-syn淀粉样纤维结合的小分子抑制剂bemcentinib,该小分子抑制剂在体外细胞模型中可有效抑制多巴胺能神经元对α-syn淀粉样纤维的摄取。为了探究bemcentinib具体的作用机制,研究人员同样依托国家蛋白质科学研究(上海)设施核磁系统Agilent 800 MHz仪器,对 bemcentinib和15N同位素标记的α-syn蛋白进行了核磁滴定实验。HSQC谱图显示bemcentinib同样造成了 15N-α-syn的羧基末端区域发生显著化学位移变化和信号强度的降低,且发生变化的氨基酸与FAM171A2蛋白滴定造成的变化氨基酸有极高重合(图2)。该结果揭示了bemcentinib通过占据α-syn与FAM171A2的结合位点来抑制二者的结合。
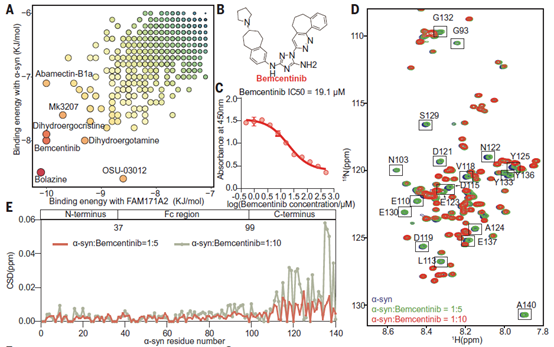
图2. 核磁滴定实验揭示小分子抑制剂bemcentinib作用机理
综上,该研究不仅提供了PD发病机制的新见解,也为开发针对这一致病机制的治疗策略提供了可能。
原文链接:https://www.science.org/doi/10.1126/science.adp3645