
小分子调控蛋白质多聚化能精准操控生命进程,在基础研究与细胞治疗领域均十分重要。西湖大学曹龙兴团队和解明岐团队提出“对接-结合同步优化”策略, 结合同步辐射线站的高分辨率结构解析技术,系统实现了小分子调控高阶蛋白质多聚体的设计与验证,为人工蛋白调控体系的构建提供了新的方法框架。
蛋白质的小分子调控多聚化是化学生物学精准操控生命过程的核心工具,在基础研究与细胞治疗中具有不可替代的价值。然而,天然调控系统稀缺,现有化学诱导二聚化(CID)系统局限于二聚化、依赖天然骨架且存在药物毒性问题,高阶多聚体(如三聚体)的从头设计长期面临瓶颈。近期,西湖大学曹龙兴团队和解明岐团队在小分子调控蛋白质多聚体的从头设计领域取得重要突破。研究成功建立对称性引导的从头设计策略,实现了小分子调控的同源三聚体、异源二聚体及异源三聚体的构建,破解了这一领域的关键难题。
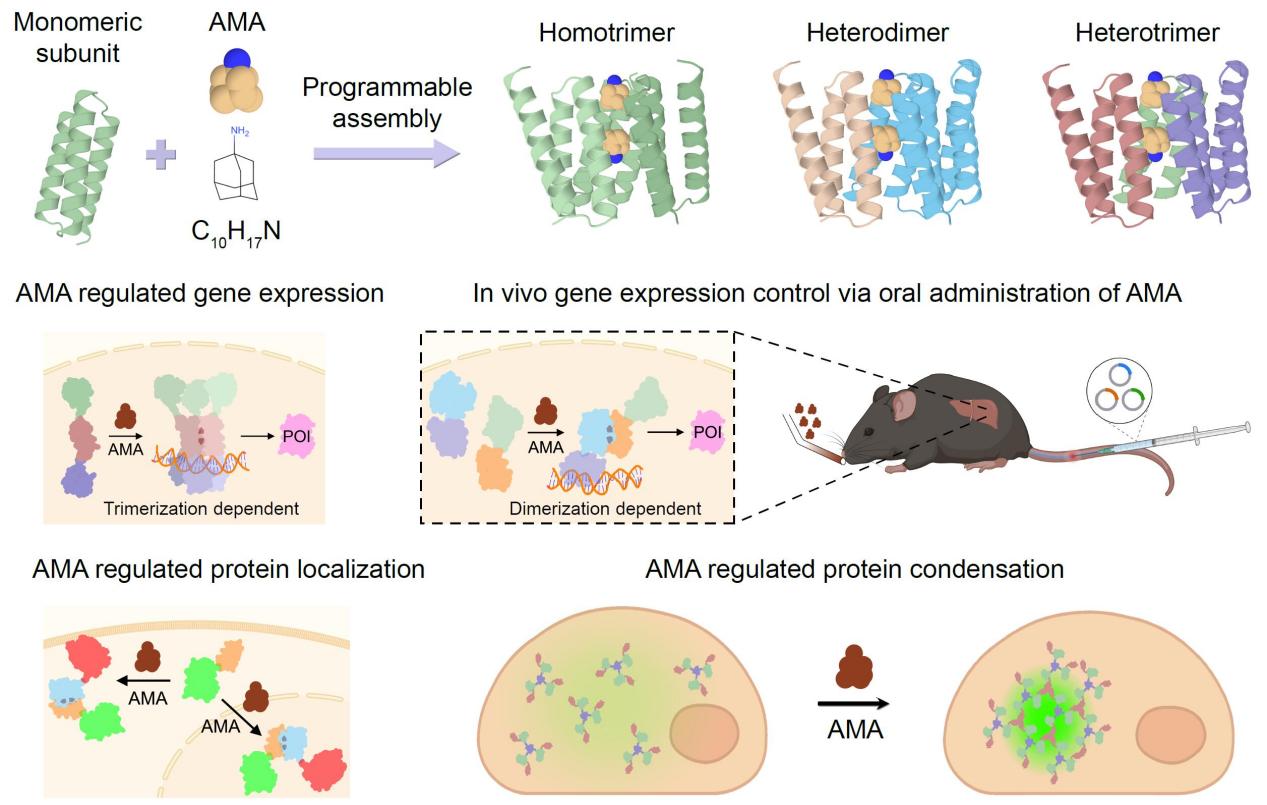
图1. 研究流程图
该研究的核心突破源于计算设计与实验验证的深度融合。团队创新性提出“对接-结合同步优化”策略,以FDA批准的C3对称性药物金刚烷胺为调控配体,通过RifGen生成小分子的对称相互作用场、蒙特卡洛采样围绕小分子组装蛋白质同源三聚体,经Rosetta与ProteinMPNN完成蛋白质序列设计,确保无配体时蛋白为稳定单体、存在配体时高效多聚化。高分辨率晶体结构解析是验证设计准确性的关键,BL19U1线站为该研究提供了核心技术支撑——依托同步辐射线站的先进衍射技术,团队成功解析了mAIT03(1.9 Å)、dAIT17(1.5 Å)等关键蛋白质-小分子复合物的高分辨率晶体结构,明确了蛋白质与金刚烷胺的结合模式,其与设计模型的Cα原子RMSD最低仅0.67 Å,直接证实了设计策略的高精度。功能验证中,该系统展现出丰富应用:剂量依赖性基因转录激活、实时可逆操控蛋白凝聚、亚细胞定位精准调控,且口服金刚烷胺可激活小鼠肝脏转基因表达,彰显转化潜力。
该研究首次实现了小分子调控高阶蛋白质多聚体的从头设计,显著拓展了传统依赖天然蛋白质体系的调控模式,为化学生物学研究提供了一类全新的可控蛋白工具。。未来,该设计策略可扩展至非对称系统,在细胞治疗安全开关、基因治疗靶向调控等领域发挥关键作用。此次成果的发布,不仅体现了我国在AI驱动蛋白质设计领域的领先地位,也彰显了重大科技基础设施对基础研究突破的核心赋能作用。该成果以“De novo design of small molecule regulated protein oligomers”为题发表在Science期刊。
蛋白质设施BL19U1线站的高分辨率蛋白质-小分子复合物衍射数据为设计模型的验证与优化提供了结构基础,是成果产出的重要支撑。